|
高考化学知识点总结《原电池原理》高频试题预测(2017年最新版)(二)
2017-08-01 02:16:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  ?CH3OH(g)? △H = —90.8kJ/mol。 ?CH3OH(g)? △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l)? △H = —571.6kJ/mol;
H2(g)+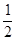 O2(g)=H2O(g)? △H = —241.8kJ/mol; O2(g)=H2O(g)? △H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g)? △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l)? △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为???。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)  ?CH3OH(g),下列表示该反应达到平衡状态的标志有???(填字母序号)。 ?CH3OH(g),下列表示该反应达到平衡状态的标志有???(填字母序号)。
A.有1个H—H键生成的同时有 3个C—H键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
| (2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题: H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol?L-1,则此时该反应v(正)?v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为?。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。
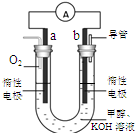
①该电池工作时,OH— 向??极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为?。
参考答案:(12分)
(1)726.5KJ/mol(2分)? BC(2分)
(2)> (2分)? 33.3% (2分)
(3)b(2分)? CH3OH + 8OH- - 6e- = CO32- + 6H2O (2分)
本题解析:
(1)①根据盖斯定律把方式程式进行加减运算,得出结果为726.5。②A应该是有2个H—H键生成的同时有 3个C—H键生成;D.容器中混合气体的密度始终不变化,无法做为判断依据;(2)①通过运用三态法计算出此温度下的平衡常数为K’=0.5*0.5/0.5*1.5=1/3<1,所以平衡正向移动,所以v(正)>v(逆)。②根据平衡常数K=1,运用三态法计算出H2O的转化率为33.3%。
(3)①该电池工作时,OH— 向负极移动,由于O2在正极参加反应,所以b极应该是负极。②负极中首先清楚是甲醇失去电子生成CO2,但由于电解质溶液呈碱性所以产物中应该有CO32-生成。所以电极反应式为CH3OH + 8OH- - 6e- = CO32- + 6H2O (2分)。
本题难度:困难
2、选择题 根据下列事实,判断离子的氧化性顺序为①A + B2+ = A2+ + B? ②D + 2H2O = D(OH)2+H2↑?
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2+ + 2e-= E,B - 2e- = B2+?(?)
A.E2+>B2+>A2+>D2+
B.D2+>A2+>B2+>E2+
C.D2+>E2+> B2+>A2+
D.A2+>B2+>D2+>E2+
参考答案:A
本题解析:考查金属性强弱比较。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
8.依据电解池中阳离子的放电(得电子,氧化性)顺序。优先放电的阳离子,其元素的金属性弱。
所以正确的答案选A。
本题难度:一般
3、选择题 某原电池的离子方程式是Zn+Cu2+=Zn2++Cu,该原电池正确的组成是
[? ]
?
正极
负极
电解质溶液
A.
?Cu
?Zn
HCl
B.
?Zn
Cu?
CuSO4
C.
Cu
Zn
CuSO4
D.
Cu
Zn
ZnCl2
参考答案:C
本题解析:
本题难度:一般
4、填空题 氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2
燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验:
①氢氧燃料电池中,正极的电极反应式为____________

②上图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为____________L
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g); 2NH3(g);
ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
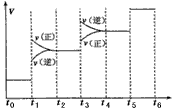
图中t1时引起平衡移动的条件可能是____________其中表示平衡混合物中NH3的含量最高的一段时间是
____________
②温度为T℃时,将2a mol H2和amol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
参考答案:(1)2H2(g)+O2(g)==2H2O(l);ΔH=-571.6 kJ/mol
(2)①O2+4e-+2H2O=4OH-;②0.56
(3)①增大压强;t2-t3;②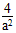
本题解析:
本题难度:困难
5、选择题 某原电池的总反应是Zn+Cu2+=Zn2++Cu,该原电池的正确组成是( )
? A? B? C? D
正?极?Zn?Cu?Zn?Cu
负?极?Cu?Zn?Cu?Zn
电解质溶液?CuCl2?CuCl2?ZnCl2?ZnCl2.
A.A
B.B
C.C
D.D
参考答案:A、锌的活泼性大于铜,锌作负极铜作正极,所以A装置不符合该原电池反应,故A错误.
B、锌的活泼性大于铜,锌作负极铜作正极,电解质溶液中的铜离子得电子发生还原反应,所以B装置符合该原电池反应,故B正确.
C、锌的活泼性大于铜,锌作负极铜作正极,电解质溶液应为铜盐溶液,所以C装置不符合该原电池反应,故C错误.
D、锌的活泼性大于铜,锌作负极铜作正极,电解质溶液应为铜盐溶液,所以D装置不符合该原电池反应,故D错误.
故选B.
本题解析:
本题难度:简单
|
 H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题: