微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知298K时, N2(g)+3H2(g)="2" NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
A.Q1 = Q2 =" 92.4kJ"
B.Q2 < Q1 = 92.4kJ
C.Q2< Q1<92.4kJ
D.Q2 = Q1< 92.4kJ
参考答案:C
本题解析:题给热化学方程式中的△H=-92.4kJ/mol是指1molN2(g)和3molH2(g)和完全反应的反应热。而将1molN2(g)和3molH2(g)在一定条件下反应时,是一个可逆反应,不可能全部反应,故反应放出的热量应小于92.4KJ。另一容器中的反应建立的平衡与前一容器建立的平衡应为等效平衡,平衡时各物质的量相等,但由于第二种情况下,容器中已有0.1molNH3,故反应再生成的NH3较第一种情况少,故Q2<Q1[点拨]:本题不仅考查了反应热的概念,还同时考查了可逆反应,等效平衡等概念,综合性较强,考生只有在准确理解上述概念的基础上,才能准确做答。由于“化学反应中的能量变化”,新教材已将其作为另一条主线贯穿于教材始终,故能量变化问题几乎可与任何一章相联系、相综合,复习中应多加留意。
本题难度:简单
2、填空题 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为?,含有离子键、?等化学键。
(2)生成物中含有10个电子的分子是?(写分子式),该分子的空间构型为?,中心原子的杂化方式为?。
(3)反应物中电负性最大的元素为?(填元素符号),写出其原子最外层的电子排布图:?。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
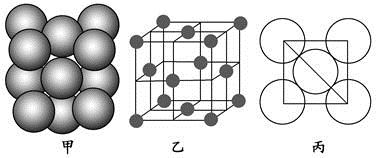
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为?;Al晶体的密度为?(用字母表示)。
参考答案:(1)Na3AlF6 配位键
(2)H2O V形 sp3
(3)F 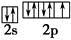
(4)4 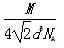
本题解析:(1)冰晶石的化学式为Na3AlF6,Na+与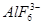 之间为离子键,而
之间为离子键,而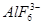 是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为
是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为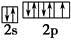 。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×
。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×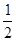 +8×
+8×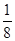 =4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为
=4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为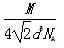 。
。
本题难度:一般
3、填空题 I.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
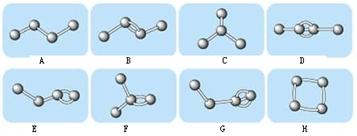
(1)图中属于烷烃的是?(填编号);属于烯烃的是?(填编号);
(2)上图中与B互为同分异构体但不属于同种类的物质的是:?。(填编号)
II.课本“交流?研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能量;形成水分子中1 mol? H—O键能够释放463kJ能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
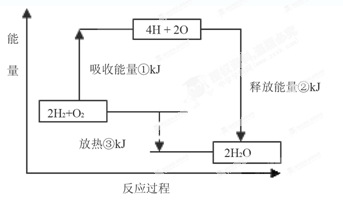
①?kJ;②?kJ;③?kJ。
参考答案:(12分)I. AC? BEF? H? II.①1370?②1852?③482(每空2分)
本题解析:(1)烷烃是只含有C—H键、C—C键的链状烃,不含C=C或C≡C或环状结构,可以含有支链结构,则图中A、C代表的烃(正丁烷、异丁烷)属于烷烃;烯烃是含有1个C=C和若干个C—H键、C—C键的链状烃,不能含有环状结构,可以含有支链结构,则图中B、E、F代表的烃属于烯烃;(2)根据碳四价规律,每个球表示1个碳原子,每个碳原子周围短线数+与碳原子相连的氢原子数目=4,则图中A、B、C、D、E、F、G、H的碳、氢原子数均可推断,其分子式分别为C4H10、C4H8、C4H10、C4H6、C4H8、C4H8、C4H6、C4H8,则与B互为同分异构体的是E、F、H,其中B、E、F均属于烯烃,而H属于环烷烃;
II.①由于破坏1mol氢气中的化学键需要吸收436kJ能量,破坏1/2mol氧气中的化学键需要吸收249kJ的能量,则破坏2mol氢气中的化学键需要吸收2×436kJ能量,破坏1mol氧气中的化学键需要吸收2×249kJ的能量,因此同时破坏2mol氢气和1mol氧气中的化学键需要吸收的总能量为2×436kJ +2×249kJ=1370kJ;②1个H2O分子含有2个H—O键,则2molH2O(g)中含有4molH—O键,由于形成水分子中1 mol? H—O键能够释放463kJ能量,则形成2molH2O(g)中的4molH—O键能够释放的总能量为4×463kJ=1852kJ;③由于破坏2mol氢气和1mol氧气中的化学键需要吸收的总能量为1370kJ,形成2molH2O中的4molH—O键能够释放的总能量为1852kJ,1370kJ<1852kJ,则2mol氢气和1mol氧气反应生成2molH2O(g)时放出的热量为482kJ。
本题难度:一般
4、填空题 (7分)如图所示,把试管小心地放入盛有(20 ℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL稀盐酸于试管中。试回答下列问题:

(1)实验中观察到的现象是_________________________________________________。
参考答案:
本题解析:
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:NH+4、Na+、I-、NO-3
B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.能使甲基橙变红的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
参考答案:C
本题解析:分析:A.pH=1的溶液显酸性,离子之间发生氧化还原反应;
B.由水电离的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液;
C.能使甲基橙变红的溶液,pH<3.1,溶液显酸性;
D.离子之间结合生成络离子.
解答:A.pH=1的溶液显酸性,H+、I-、NO3-离子之间发生氧化还原反应,则不能共存,故A错误;
B.由水电离的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,则不能共存,故B错误;
C.能使甲基橙变红的溶液,pH<3.1,溶液显酸性,该组离子之间不反应,能共存,故C正确;
D.Fe3+、SCN-离子之间结合生成络离子,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确信息是解答本题的关键,注意发生的氧化还原反应及信息的抽取是解答的难点,题目难度中等.
本题难度:一般