微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)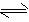 Z(g)+W(s);△H<0下列叙述正确的是
Z(g)+W(s);△H<0下列叙述正确的是
[? ]
A.增加少量W,正反应速率减小
B.当容器中气体的密度不变时,反应达到平衡
C.降低温度,平衡不移动
D.平衡后加入Z ,上述反应的△H减小
参考答案:B
本题解析:
本题难度:一般
2、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是?
[? ]
A、反应混合物的浓度?
B、反应体系的压强?
C、正、逆反应的速率?
D、反应物的转化率
参考答案:D
本题解析:
本题难度:一般
3、选择题 在恒容的各个密闭容器中,下列反应分别达到平衡后,有关说法正确的是
[? ]
A.2HI(g) H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
B.2NO2(g) N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
C.2SO2(g)+O2(g)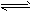 2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小
2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小
D.3Fe(s)+4H2O(g)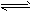 Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
参考答案:C
本题解析:
本题难度:一般
4、填空题 (本题共12分)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=  Q(Q>0)。
Q(Q>0)。
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
c(NO)/mol·L-1
| 1.00×10-3
| 4.50×10-4
| 2.50×10-4
| 1.50×10-4
| 1.00×10-4
| 1.00×10-4
|
c(CO)/mol·L-1
| 3.60×10-3
| 3.05×10-3
| 2.85×10-3
| 2.75×10-3
| 2.70×10-3
| 2.70×10-3
|
29.写出该反应的平衡常数表达式__________________________________________。
30.前2s内的平均反应速率υ(N2) = mol/(L·s);达到平衡时,CO的转化率为 。
31.下列描述中能说明上述反应已达平衡的是________________
A.2υ正(NO)=υ逆(N2)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的转化率不再发生变化
32.采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,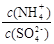 的值将 (填“变大”、“不变”或“变小”)
的值将 (填“变大”、“不变”或“变小”)
33.有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是________________(填编号);
34.向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象__________________________________________________________。
参考答案:29.K=c(N2)·c(CO2) 2/ 91ExaM.orgc(NO)2·c(CO)2 (1分)
30.1.875×10-4 mol/(L·s) (2分)25% (2分)
31.B、D (2分) 32.变大 (1分) 33.②>①>③(2分)
34.饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀。加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生。(2分)
本题解析:29.反应2NO(g)+2CO(g)  N2(g)+2CO2(g)的化学平衡常数是K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2;
N2(g)+2CO2(g)的化学平衡常数是K=c(N2)·c(CO2) 2/c(NO)2·c(CO)2;
30. 在前2s内,c(NO)由1.00×10-3mol/L变为2.50×10-4mol/L,改变了7.50×10-4mol/L,则根据方程式中NO与N2的反应关系可知N2浓度是7.50×10-4mol/L÷2=3.75mol/L。则V(N2)= 3.75mol/L÷2s=1.875×10-4 mol/(L·s);达到平衡时,CO的转化率为[(3.60×10-3mol/L-2.70×10-3mol/L)÷3.60×10-3mol/L]×100%=25%;
31. A.在任何时刻都存在:υ正(NO)=2υ正(N2) 。若2υ正(NO)=υ逆(N2),则υ逆(N2)=4υ正(N2) ,用同一种物质表示的化学反应速率,正逆反应速率不等,反应没有处于平衡状态,错误; B.由于该反应是反应前后气体体积不等的质量不变的反应,若反应达到平衡状态,则气体的物质的量不变,容器中气体的平均分子量就不变,因此容器中气体的平均分子量应不随时间而变可以证明反应处于平衡状态,正确;C.由于该反应反应物和生成物都是气体,容器的容积不变,所以在任何时刻容器中气体的密度都不会发生变化,因此不能作为判断平衡的标志,错误; D.若容器中CO的物质的量发生变化,反应就没有达到平衡状态,若达到平衡状态,则CO的物质的量不变,CO的转化率不变,反应处于平衡状态,正确;
32.往(NH4)2SO4的稀溶液中再加入少量(NH4)2SO4固体,溶液的浓度增大。由于该盐是强酸弱碱盐,NH4+会发生水解反应而消耗,浓度增大,盐的水解平衡逆向移动,盐水解的程度减小,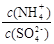 的值将变大。
的值将变大。
33.在三种盐溶液中都存在NH4+的水解作用,NH4++H2O NH3·H2O+H+;NH4+水解使溶液显酸性,在NH4HCO3溶液中除了存在NH4+水解外,还存在HCO3-的水解作用:HCO3-+H2O
NH3·H2O+H+;NH4+水解使溶液显酸性,在NH4HCO3溶液中除了存在NH4+水解外,还存在HCO3-的水解作用:HCO3-+H2O H2CO3+OH-;HCO3-水解使溶液显碱性,二者的水解的酸碱性相反,对彼此的水解起促进作用,所以水解程度增大。对于NH4HSO4来说,是强酸的酸式盐,NH4HSO4=NH4++H++SO42-。电离产生的H+对NH4+的水解平衡起抑制作用,是其水解程度减小。所以① NH4Cl、②NH4HCO3、③NH4HSO4这三种溶液中水的电离程度由大到小的顺序是②>①>③;
H2CO3+OH-;HCO3-水解使溶液显碱性,二者的水解的酸碱性相反,对彼此的水解起促进作用,所以水解程度增大。对于NH4HSO4来说,是强酸的酸式盐,NH4HSO4=NH4++H++SO42-。电离产生的H+对NH4+的水解平衡起抑制作用,是其水解程度减小。所以① NH4Cl、②NH4HCO3、③NH4HSO4这三种溶液中水的电离程度由大到小的顺序是②>①>③;
34.由于酸性HCl>H2SO3,所以向BaCl2溶液中通入足量SO2气体,只发生化合反应:SO2+H2O= H2SO3,H2SO3是弱酸,电离产生的SO32-浓度很小,没有发生复分解反应生成沉淀生成,继续滴加一定量的氨水后,氨水电离产生的OH-对H2SO3的电离平衡起促进作用,产生更多的SO32-,使c(SO32-)增大,SO32-就与溶液中的Ba2+结合生成BaSO3沉淀。
考点:考查化学平衡常数的表达式的书写、化学平衡状态的判断、盐的水解程度的大小比较及影响因素、程度平衡理论的应用、化学反应速率和物质的平衡转化率的计算的知识。
本题难度:困难
5、计算题 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3
| CO
| Fe
| CO2
|
甲/mol
| 1.0
| 1.0
| 1.0
| 1.0
|
乙/mol
| 1.0
| 1.5
| 1.0
| 1.0
|
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
编号
| 温度/K
| 反应时间/h
| 反应物物质的量配比
| 实验目的
|
①
| 378
| 4
| 3∶1
| 实验②和④探究________
______________________
实验②和__________探究
反应时间对产率的影响。
|
②
| 378
| 4
| 4∶1
|
③
| 378
| 3
| _______
|
④
| 398
| 4
| 4∶1
|
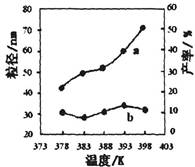
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。
参考答案:(16分)I.(1)△H1 -3△H2(2分)
(2) (3分) 注:用“[ ]”表示平衡浓度的也给分
(3分) 注:用“[ ]”表示平衡浓度的也给分
(3)①60%(2分) ②B(2分)
II. 4∶1(1分) 温度对产率的影响(2分) ③(1分)
在378~398K(1分),生成的纳米MgO的粒径大小无明显变化(合理则给分)(2分)
或者:在378K~398K(1分或在实验温度下也得分),随温度的升高,产率增大(2分)
383K较低温度下有利于形成较小的颗粒(3分)
注:填“在实验温度下”也得分。
本题解析:(1)观察已知热化学方程式,根据盖斯定律,可以用①-②×3约去3C(石墨),得到高炉炼铁的反应式,则Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g)的△H =①的焓变-②的焓变×3=△H1 -3△H2;(2)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写进表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
2Fe(s)+3CO2(g)的△H =①的焓变-②的焓变×3=△H1 -3△H2;(2)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写进表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
Fe2O3(s) + 3CO(g)  2Fe(s) + 3CO2(g)
2Fe(s) + 3CO2(g)
起始浓度/ mol·L-1 0.5 0.5
变化浓度/ mol·L-1 0.5x 0.5x
平衡浓度/ mol·L-1 0.5-0.5x 0.5+0.5x
K=c3(CO2)/c3(CO)="(" 0.5+0.5x) 3/(0.5-0.5x)3=64
( 1+x) 3/(1-x)3=64,则( 1+x)/(1-x)=4,1+x=4-4x,5x=3,x=0.6或60%
②正反应是气态物质体积保持不变的反应,则反应前后气态物质的物质的量保持不变,则平衡前后气体的压强不变,故A错误;混合气体的密度=混合气体的总质量/容器的容积,由于反应物和生成物中都有固体物质参加,且平衡前混合气体的总质量会增大,只有平衡时混合气体的总质量才保持不变,密度才不变,故B正确;正反应是气态物质体积保持不变的反应,增大CO浓度必然同时增大压强,增大压强时该平衡不能移动,CO的转化率不变,故C错误;氧化铁的固体,其浓度是常数,增加氧化铁的量不能增大反应物浓度或压强,平衡不会移动,则CO的转化率不变,故D错误;(4)根据控制变量设计探究实验方案的原理可知,实验①和②探究的目的是反应物配比对纳米MgO产率的影响,实验②和④探究的目的是温度对纳米MgO产率的影响,实验②和③探究的目的是反应时间对纳米MgO产率的影响;读图可知,在378~398K,生成的纳米MgO的粒径大小无明显变化,或者在378K~398K(或在实验温度下),随温度的升高,产率增大,383K较低温度下有利于形成较小的颗粒。
考点:考查化学反应原理大题,涉及盖斯定律的应用、化学平衡常数及应用、平衡转化率的计算、化学平衡移动、设计几种因素影响产率的探究实验、解释化学平衡图像等知识。
本题难度:困难