微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 按照物质的树状分类和交叉分类,HNO3应属于:①酸②氢化物?③氧化物?④含氧酸?⑤一元酸?⑥强酸?⑦化合物?⑧有机物?⑨无机化合物
A.①④⑤⑥⑦⑨
B.①②③④⑤⑥⑦⑨
C.①②④⑧
D.①④⑤⑥
参考答案:A
本题解析:按照物质的树状分类和交叉分类,HNO3应属于:①酸、④含氧酸、⑤一元酸、⑥强酸、⑦化合物、⑨无机化合物
本题难度:简单
2、选择题 由①CaCO3、②KI、③Al(OH)3、④AgOH(Ag2O)、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是?
A.氨水乙醇水氢氧化钾硝酸
B.四氯化碳水氨水氢氧化钠盐酸
C.水苯氨水氢氧化钾硝酸
D.水盐酸氢氧化钠氨水乙醇
参考答案:B
本题解析:碘易溶在有机溶剂中,因此首先用四氯化碳溶解碘;碳酸钙不溶于水,氢氧化银钠溶解在氨水中,而氢氧化铝不能,但氢氧化铝钠溶解在氢氧化钾中,所以正确的答案选B。
本题难度:简单
3、选择题 下列分类图表示的关系完全正确的是(?)
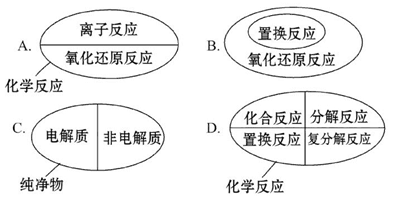
参考答案:B
本题解析:化学反应从不同的角度有不同的分类方法,如从有无电子得失角度可以分为氧化还原反应和非氧化还原反应,从反应物和生成物的种类和特点角度可以分为四种基本反应类型,从有无离子参与的角度可以分为离子反应和非离子反应,A和D选项的分类都不全面;置换反应一定有化合价的变化,一定属于氧化还原反应,B选项正确;电解质和非电解质都属于化合物,都属于纯净物,但是纯净物还包含单质,C选项不正确。
本题难度:一般
4、选择题 下列说法正确的是( )
A.0.1mol?Na2O2与足量CO2反应转移的电子的物质的量为0.2mol
B.非金属氧化物不一定是酸性氧化物,但金属氧化物都为碱性氧化物
C.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
D.某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶了较多的CO2
参考答案:A.过氧化钠既是氧化剂又是还原剂,过氧根离子中的氧为-1价,一半氧原子化合价升高,生成氧气,另一半氧原子化合价降低,生成-2价的氧,故0.1 mol过氧化钠参与反应时转移电子的量为0.1 mol,故A错误;
B.酸性氧化物是指能与水反应生成相应的酸,而不生成其他物质的氧化物,碱性氧化物为能与水反应生成相应的碱,而不生成其他物质的氧化物,非金属氧化物不一定是酸性氧化物,如一氧化碳,金属氧化物不一定是碱性氧化物,如超氧化钾等,故B错误;
C.电解熔融氯化钠时,钠离子得电子为氧化剂,被还原,氯离子失电子,被氧化,故C正确;
D.酸雨样本放置一段时间后,因为溶解在其中的二氧化碳和二氧化硫生成了碳酸和亚硫酸,碳酸和亚硫酸电离出氢离子,使PH值减小,故D错误;
故答案为C.
本题解析:
本题难度:一般
5、填空题 生活和生产中常用到胶体的性质,请看下述四例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是
_______________________________________________。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是________。
(3)水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了________原理。
(4)四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁酸盐(FeO42—),FeO42—有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 ______________________________________________________
参考答案:(1)电解质氯化铁使血液中蛋白质胶体凝聚
(2)陶土胶粒带负电荷,向阳极移动,氧化铁胶粒带正电荷.向阴极移动
(3)电泳
(4)其还原产物Fe3+水解生成的Fe(OH)3胶体可以凝聚水中的悬浮物从而有净水作用
本题解析:本题主要考查胶体的性质和用途。
(2)由于陶土胶粒带负电荷,氧化铁胶粒带正电荷,所以电解时前者胶粒向阳极移动,后者胶粒向阴极移动。(4)FeO42—有强氧化性,对应的还原产物Fe3+水解生成的Fe(OH)3胶体,可以凝聚水中的悬浮物而净水。
本题难度:简单