| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡》高频考点预测(2017年最新版)(六)
参考答案:D 本题解析:A、参加反应的B为1.5mol,浓度是1.5mol÷2L=0.75mol/L,则v(B)=0.75mol/L÷5min=0.15mol/(L?min),故A不正确;B、起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD 本题难度:一般 2、选择题 关于平衡常数K,下列说法中正确的是( ? ) 参考答案:B 本题解析: 本题难度:简单 3、选择题 已知在一定条件下, 2SO2+O2 |
参考答案:C
本题解析:催化剂只能加快反应速率,并不影响化学平衡,所以二氧化硫的转化率不变,答案选C。
考点:考查催化剂对化学平衡的影响
本题难度:一般
4、计算题 (10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示: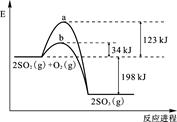
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:
①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
参考答案:(1)2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol (2)b
2SO3(g),ΔH=-198 kJ/mol (2)b
(3)① 0.225 mol·L-1·min-1 ② 0.9mol/L<c(SO3)<1 mol/L (4)>
本题解析:(1)根据图像可知,反应是放热反应,所以热化学方程式为2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol。
2SO3(g),ΔH=-198 kJ/mol。
(2)催化剂能降低反应的活化能,但不能改变反应热,所以答案是b。
(3)①放出热量为178.2 kJ,则消耗的氧气是178.2÷198=0.9mol,所以氧气的反应速率是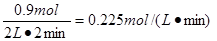 。
。
②在冲入氧气之前生成三氧化硫是1.8mol,但反应是可逆反应,所以无论冲入多少氧气,三氧化硫的物质的量不能超过2mol,所以浓度范围是0.9mol/L<c(SO3)<1 mol/L。
(4)乙是保持恒压的,又因为反应是体积减小的可逆反应,所以乙中反应物的转化率要大于甲中的,即放出的热量大于Q kJ。
本题难度:困难
5、选择题 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )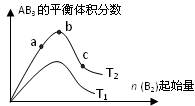
A.反应速率a>b>c
B.达到平衡时,AB3的物质的量大小为:b > c > a
C.若T2>T1,则正反应一定是吸热反应
D.达到平衡时A2的转化率大小为:b>a>c
参考答案:C
本题解析:反应物的浓度越大,反应速率越大,因此根据图像可知,反应速率应该是c>b>a,选项A不正确;体积分数大,但物质的量不一定是最大的,选项B不正确,应该是c>b>a;若T2>T1,则说明升高温度,AB3的平衡体积分数增大,因此正反应是吸热反应,选项C正确;D不正确,B2的物质的量浓度越大,A2的转化率越高,所以应该是c>b>a,答案选C。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《与量有关的.. | |