微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组性质的比较中,不正确的是( )
A.碱性:NaOH>Mg(OH)2
B.原子半径:Cl>S
C.金属性:K>Na
D.热稳定性:NH3>PH3
参考答案:A、同一周期元素的原子,从左到右,最高价氧化物对应水化物的碱的碱性逐渐减弱,所以碱性:NaOH>Mg(OH)2,故A正确;
B、同一周期元素的原子,从左到右,原子半径逐渐减小,所以原子半径:Cl<S,故B错误;
C、同一主族元素,从上到下,金属性逐渐增强,则金属性:K>Na,故C正确;
D、同主族元素的原子,从下到上,得电子能力逐渐增强,气态氢化物稳定性逐渐增强,所以稳定性:NH3>PH3,故D正确.
故选B.
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是( )
A.N、O、S元素的原子半径依次增大
B.由于Si原子半径较大,SiH4比CH4稳定
C.若aXm+和bYN-两种离子电子层结构相同,则a-b=n-m
D.元素周期表从IIIB族到IIB族10个纵列的元素都是金属元素
参考答案:A、同周期原子半径从左向右在减小,则原子半径N>O,同主族元素的原子半径从上到下在增大,则原子半径S>O,S的电子层最多,则硫原子半径最大,氧原子半径最小,故A错误;
B、因非金属性C>Si,则气态氢化物的稳定性为CH4>SiH4,故B错误;
C、因两种离子电子层结构相同,则a-m=b+n,即a-b=m+n,故C错误;
D、从IIIB族到IIB族10个纵列的元素为过渡元素,过渡元素都是金属元素,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列性质比较,正确的是( )
A.非金属性:O<S
B.碱性:NaOH>Mg(OH)2
C.稳定性:H2O<H2S
D.酸性:H3PO4>H2SO4
参考答案:A.同主族元素从上到下元素的非金属性逐渐减小,应为O>S,故A错误;
B.金属性Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故B正确;
C.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.非金属性S>P,酸性:H3PO4<H2SO4,故D错误.
故选B.
本题解析:
本题难度:简单
4、填空题 写出下列原子的电子排布式并指出它们在周期表中的位置。
(1)Cu____________________第____周期____族
(2)Cr____________________第____周期____族
(3)Se____________________第____周期____族
(4)Zn____________________第____周期____族
(5)Fe____________________第____周期____族
参考答案:(1)1s22s22p63s23p63d104s1;四;IB
(2)1s22s22p63s23p63d54s1;四;VIB
(3)1s22s22p63s23p63d104s24p4;四;VIA
(4)1s22s22p63s23p63d104s2;四;IIB
(5)1s22s22p63s23p63d64s2;四;VIII
本题解析:
本题难度:一般
5、推断题 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)C是________,E是________
(2)写出C元素基态原子的电子排布式________
(3)用轨道表示式表示D元素原子的价电子构型__________
(4)元素B与D的电负性的大小关系是________,C与E的第一电离能的大小关系是_______。(填“>”、 “<”或“=”)
(5)由这五种元素组成的一种化合物是(写化学式)________。写出该物质的一种主要用途________。
参考答案:(1)Al(铝);K(钾)
(2)1s22s22p63s23p1(3)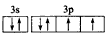 (4)O>S;Al>K
(4)O>S;Al>K
(5)KAl(SO4)2·12H2O;净水剂
本题解析:
本题难度:一般