微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下表列出了①~⑦七种元素在元素周期表中的位置.
族
周期 | ⅠA | | | | | | | 0
一
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
二
⑤
⑥
三
②
③
④
⑦
|
请回答下列问题:
(1)①、⑤、⑥三种元素相比较,非金属性最强的元素是______(填元素符号);
(2)元素⑤、⑥、⑦的氢化物的化学式分别是______、______、______;
(3)②、④两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是;
(4)七种元素中,原子半径最小的是______(填序号);
(5)②、③、④三种元素最高价氧化物的水化物碱性由强到弱的顺序是______(填化学式).
2、选择题 已知115号元素原子有七个电子层,且最外层有5个电子,试判断115号元素在元素周期表中的位置是?
[? ]
A.第七周期第IIIA族
B.第七周期第VA族
C.第五周期第VIIA族
D.第五周期第IIIA族
3、推断题 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。 ?
(1)W在元素周期表中的位置是_____________。
(2)?2.24?L(标准状况)XQ3被200?mL?1?moL/L?QXY3,溶液吸收后,所得溶液中离子浓度从大到小的顺序是___________________。
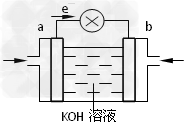
(3)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______________________。
(4)已知:
W(s)+Y2(g)=WY2(g)? △H=?-393.5?kJ/mol ?
WY(g)+1/2Y2(g)=WY2(g)?△H=?-283.0?kJ/mol ?
24g?W与一定量的Y2反应,放出热量362.5?kJ,所得产物的物质的量之比是__________。
(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是____________________________。
4、选择题 Se(硒)是第四周期的ⅥA族元素,根据元素周期表和元素周期律分析,以下说法中错误的是
A.Se能形成SeO2、SeO3两种氧化物
B.原子半径:Se>S
C.H2Se比H2S稳定
D.酸性:H2SeO4比H2SO4弱
5、选择题 下列说法中错误的是
[? ]
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族之间的10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质不同、化学性质相似