| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《物质组成与性质实验方案的设计》高频考点预测(2017年最新版)(二)
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42- (Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。 甲同学认为沉淀可能是CuCO3;?乙同学认为沉淀可能是Cu(OH)2; 丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。 [查阅资料知:CuCO3和Cu(OH)2均不带结晶水] (1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为? (2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。 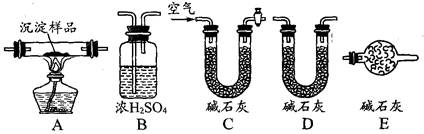 ①实验装置的连接顺序为_________________________________。 ②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。 ③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。 参考答案:(Ⅰ)D(2分)? 本题解析:(Ⅰ)A.溶液及胶体均可全部通过滤纸,不正确 本题难度:一般 3、实验题 某厂废水中含5.00×10-3?mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: 参考答案:(1)Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O 本题解析: 本题难度:一般 4、选择题 如右图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾。则A与B可能是?(?) 参考答案:D 本题解析:略 本题难度:简单 5、实验题 乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
请回答下列问题: (1)读表若只进行实验1和实验3,其探究目的是?。 (2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是?;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的?。 (3)进一步实验?若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验? ?。 Ⅱ. 探究对废液的回收处理: 银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:  操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl  2 Ag+ FeCl2+H2S↑。 2 Ag+ FeCl2+H2S↑。(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为:?,需要用到的玻璃仪器有?(填编号)。  a? b? c? d? e? f? g (5)操作④应在(填实验室设备名称)?中进行。 (6)要洗去试管壁上的银镜,采用的试剂是?(填名称)。 参考答案:(17分) 本题解析:(1)依题意,对比表中实验1和3,二者使用乙醛的量分别是3滴、5滴,其它条件保持不变,出现银镜时间分别为5min、4min,说明这组实验探究的目的是比较乙醛用量不同时生成银镜的时间(速度或质量);(2)依题意,实验4、2、5的探究目的是比较不同温度时生成银镜的时间(速度或质量),30℃、45℃、50℃出现银镜的时间分别为9min、6.5min、6min,由于30℃<40℃<45℃,则40℃出现银镜的时间应该介于30℃、45℃出现银镜的时间之间,即在6.5min ~9min之间;出现银镜的时间表示化学反应速率的快慢,最佳反应条件还应包括形成的银镜的光亮程度或亮度、外观、效果等;(3)根据控制变量设计实验方案的原则,应保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间,以探究银氨溶液的用量对出现银镜快慢的影响;(4)由金属活动性顺序表可知,Fe>H2>Ag,则铁粉与非氧化性酸能发生置换反应,生成亚铁盐溶液、放出氢气,而银不溶于非氧化性,因此选择过量的稀盐酸除去银粉中混有的少量铁粉,即Fe+2H+=Fe2++H2↑,充分反应后过滤、洗涤得到的沉淀就是不含铁的银;溶解、过滤常常需要使用的仪器是烧杯、漏斗、玻璃棒,故bef正确;(5)铁粉还原硫化银时,由于Ag2S+Fe+2HCl 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《物质的组成.. | |