微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 六种短周期元素aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=
;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻.
(1)E、F形成的化合物甲的电子式为______,该化合物与A2C反应的化学方程式:______.
(2)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:______.
(3)已知B+BEC3-B2C+E2,请将方程式配平后用双线桥表示电子的转移情况______.
(4)A、E形成的四原子核化合物丙容易液化,其原因是:______.由A、C、E三种元素形成的离子化合物溶液中,离子浓度由大到小顺序为______.
(5)经检测,某固体粉末中仅含有B、C两种元素组成的化合物,请设计实验方案探究该固体粉末的成分______.
参考答案:由a+b=(c+d)2可知,a只能为第一周期元素,则a为H元素,根据a<e<c<b且A、B同主族,可知B不可能为Li,应为Na元素,设C的原子序数为x,则D的原子序数为x+8,则有
x+x+8=2×(1+11),x=8,所以C为O元素,D为S元素,C、E相邻,且e<c,则E为N元素,B、F也相邻,且b<f,则F为Mg元素,则A为氢,B为钠,C为氧,D为硫,E为氮,F为镁,
(1)E、F形成的化合物为Mg3N2,为离子化合物,电子式为
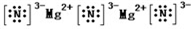
,与水发生反应生成
Mg(OH)2和NH3,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:
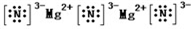
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)H、O、Na、S对应的化合物有Na2SO4?10H2O、NaHSO4、NaHSO3等,两种化合物的水溶液相互反应的为NaHSO4和NaHSO3,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(3)反应的方程式为10Na+2NaNO3=6Na2O+N2↑,反应中10Na失去10个电子,电子转移数目为10,可表示为:
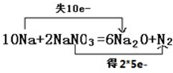
,故答案为:

;
(4)A、E形成的四原子核化合物为NH3,氨分子之间易形成氢键而导致易液化,由A、C、E三种元素形成的离子化合物为
NH4NO3,为强酸弱碱盐,NH4+水解,溶液呈酸性,则溶液中的离子浓度大小为NO3->NH4+>H+>OH-,
故答案为:氨分子之间易形成氢键;NO3->NH4+>H+>OH-;
(5)B、C两种元素组成的化合物为Na2O2、Na2O,Na2O2与水反应生成氧气,有气体生成,而Na2O与水反应没有气体生成,以此可判断是否有Na2O2,根据反应的气体的体积与反应物质量之间的关系可判断固体的成分,具体做法是将粉末加入水中,若无气体生成,则为Na2O,若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物,
故答案为:可能的组成为Na2O2,Na2O或两个都有.将粉末加入水中,若无气体生成,则为Na2O,若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物.
本题解析:
本题难度:简单
2、简答题 C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(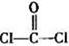 )分子中含有______个
)分子中含有______个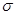 键,____个
键,____个 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图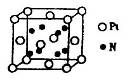 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
参考答案:(除注明外,每空1分,共8分)(1)1s22s22p6?(2)3;1;sp2
(4)H2O分子间形成氢键 (5)PtN2
本题解析:(1)O2-核外有10个电子,根据构造原理可知,其核外电子排布式为1s22s22p6。
(2)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由大到小的顺序为N<O<C。
(3)单键都是σ 键,双键是由一个σ 键和1个π键构成的。所以根据光气的结构式可知,光气分子中含有3σ键,一个π键,碳原子含有3个σ 键且不含孤电子对,所以其杂化方式为sp2。
(4)O、S属于同一主族元素,硫化氢的相对分子质量大于水,但水中含有氢键,导致水的熔点比H2S的熔点高。
(5)根据晶胞结构并依据均摊法可知,N原子个数=8个,Pt原子个数=8×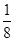 +6×
+6×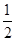 =4个,所以其化学式为PtN2。
=4个,所以其化学式为PtN2。
本题难度:一般
3、选择题 短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )
A.元素A、C的最高价氧化物对应的水化物都是弱酸
B.元素B能与A的最高价氧化物发生置换反应
C.元素B和D能形成BD2型的共价化合物
D.D的单质有毒,且有漂白性
参考答案:由题中信息可知A为C,B为Mg,C为S,D为Cl,则
A.A为C,对应的最高价氧化物的水化物为碳酸,属于弱酸,故A错误;
B.根据反应:2Mg+CO2?点燃?.?2MgO+C,该反应为置换反应,故B正确;
C.B为Mg,D为Cl,二者形成的化合物为离子化合物,故C错误;
D.D为Cl,干燥的氯气没有漂白性,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 下列物质中,含有非极性键的共价化合物是
[? ]
A.CH3CH3
B.Na2O2
C.NaCl
D.N2
参考答案:A
本题解析:
本题难度:简单
5、选择题 同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是
[? ]
A.它是一种共价化合物
B.在加热时此化合物可以分解为PH3和HI
C.这种化合物不能跟碱反应
D.该化合物可以由PH3和HI化合而成
参考答案:D
本题解析:
本题难度:一般