| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》考点特训(2017年冲刺版)(八)
参考答案:D 本题解析:从1 L 1 mol/LNaOH溶液中取出100 ml,浓度仍为1 mol/L,所含溶质为0.1mol质量为4g。故D错误。 本题难度:一般 2、选择题 配制100 mL2.0 mol·L-1 NaOH溶液时,不需要用到的仪器是 参考答案:D 本题解析: 本题难度:简单 3、选择题 标况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为 |
参考答案:D
本题解析:1molCH4中含氢原子4NA个,即氢原子个数n个的CH4物质的量n(CH4)=n/(4NA)mol,n(CH4)=V/22.4,解得NA=5.6n/V,D正确。
考点:考查物质的量、粒子、气体体积之间的关系。
本题难度:一般
4、填空题 (14分)A、B两种固体物质的溶解度曲线如下图所示。请回答: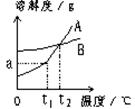
(1) ℃时,A、B两种物质的溶解度相同;
(2)我国有些地区有一种说法:“冬天捞碱,夏天晒盐”。这里的碱指Na2CO3,盐是指NaCl。那么,图中__________(填A或B)的溶解度曲线与Na2CO3的溶解度曲线相似;
(3)人们用上述方法从盐湖中捞得的Na2CO3(常含有少量的NaCl)。试计算Na2CO3的摩尔质量为 ,2mol Na2CO3中约含有 个碳原子;
(4)某研究性学习小组对捞得的碱进行分析,称取Na2CO3固体(含有少量的NaCl)样品12.5g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到0.1molCO2气体。该反应的化学方程式为 ,上述样品中含Na2CO3的物质的量为 ,质量为 。
参考答案:(每空2分,共14分)
(1)t2 (2)A
(3)106g/mol(无单位不给分,下同) 1.204×1024
(4)2HCl+Na2CO3==2NaCl+H2O+CO2↑ 0.1 mol 10.6 g
本题解析:(1)由图像可知,在t2 ℃时,A、B两种物质的溶解度相同;
(2)冬天捞碱,夏天晒盐,说明该物质温度低时溶解度较小,温度高时溶解度较大,所以A曲线符合题意,则A的溶解度曲线与Na2CO3的溶解度曲线相似;
(3)根据摩尔质量在数值上与相对分子质量相等可知,碳酸钠的摩尔质量是106g/mol;2mol Na2CO3中约含有2mol×6.02×1023mol-1=1.204×1024 个C原子;
(4)碳酸钠与足量的稀盐酸反应生成氯化钠、水、二氧化碳气体,化学方程式为2HCl+Na2CO3==2NaCl+H2O+CO2↑;根据C元素守恒,可知该碳酸钠样品中含有0.1mol的碳酸钠,质量是0.1mol×106g/mol=10.6g。
考点:考查对图像的分析,物质的量的有关计算
本题难度:一般
5、计算题 向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中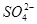 和
和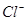 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变) 。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变) 。
参考答案:解:设混酸中含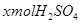 ,y mol HCl;与
,y mol HCl;与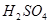 反应的
反应的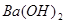 为z mol。
为z mol。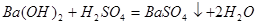
1mol? 1mol? 1mol
z? x?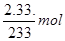 ?解得:x=0.01mol, z=0.01mol
?解得:x=0.01mol, z=0.01mol
则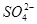 的物质的量浓度
的物质的量浓度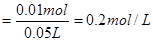 ?
?
与HCl反应的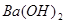 物质的量为:
物质的量为: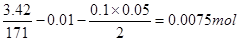
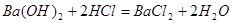
1mol?2mol
0.0075mol?y
解得:y=0.015mol则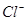 的物质的量浓度
的物质的量浓度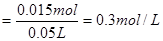 ?答:……
?答:……
本题解析:得到干燥的沉淀物为BaSO4,根据BaSO4的量可以求出H2SO4的物质的量,进而求出SO42?的浓度,然后用Ba(OH)2的总量减去剩余的Ba(OH)2和与H2SO4的Ba(OH)2,可得与HCl反应的Ba(OH)2的量,从而求出Cl?的浓度。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《键参数——.. | |