微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应离子方程式正确的是
A.向氯化铝溶液中加入过量稀氨水:Al3+ + 4OH— ="=" AlO2— + 2H2O
B.向苯酚钠溶液中通入二氧化碳CO2 + H2O + 2C6H5O—→2C6H5OH + CO32—
C.向小苏打溶液中加入醋酸溶液:HCO3— + CH3COOH ="=" CH3COO— + CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br— + 2Cl2 ="=" Fe3+ + Br2 + 4Cl—
参考答案:C
本题解析:A错,氨水中的一水合氨为弱碱,不能拆成离子形式;B错,正确的离子方程式为:CO2 + H2O + C6H5O—→2C6H5OH +H CO3—;C正确;D错,正确离子方程式为:2Fe2+ + 4Br— + 3Cl2 ="=2" Fe3+ + 2Br2 + 6Cl—
本题难度:一般
2、选择题 下列设计与离子反应方程式书写均正确的是(?)
A.磁性氧化铁溶于氢碘酸:Fe3O4+8H+ 2Fe3++Fe2++4H2O
2Fe3++Fe2++4H2O
B.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2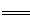 2NH4++SO32-+H2O
2NH4++SO32-+H2O
C.用浓盐酸酸化的高锰酸钾溶液与过氧化氢反应:2MnO4- +5H2O2 + 6H+ 2Mn2+ +5O2↑ + 8H2O
2Mn2+ +5O2↑ + 8H2O
D.用氨水洗涤试管内壁的银镜:Ag++2NH3·H2O [Ag(NH3)2]++2H2O
[Ag(NH3)2]++2H2O
参考答案:B
本题解析:A、发生的反应为:2I-+Fe3O4+8H+ I2+3Fe2++4H2O,错误;
I2+3Fe2++4H2O,错误;
C、高锰酸钾溶液能氧化浓盐酸,不能用浓盐酸酸化,错误;D、氨水不能溶解银,错误;
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-= 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
C.三氯化铁溶液中加入铁粉: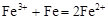
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
参考答案:D
本题解析:A.2Al+2OH-+2H2O=2AlO2-+3H2↑;错误。B.氨水是弱碱,在溶液中主要以离子的形式存在。且Al(OH)3只能被强酸、强碱溶解。因此离子方程式为:Al3++3NH3·H2O=3 NH4++Al(OH)3↓.错误;C.三氯化铁溶液中加入铁粉,没配平,电荷、电子不守恒;正确的应该是:2Fe3++Fe=3Fe2+.D,反应符合客观事实,拆写符合离子方程式的原则。正确。
本题难度:一般
4、选择题 将氢氧化钠溶液滴入Ca(HCO3)2溶液中,可能发生反应的离子方程式为
A.H+ + OH- →H2O
B.HCO3- + Ca2+ + OH- → CaCO3↓ + H2O
C.HCO3- + OH- → CO32- + H2O
D.2HCO3- + Ca2+ + 2OH- → CaCO3↓+ 2H2O + CO32-
参考答案:BD
本题解析:
分析:将氢氧化钠溶液滴入Ca(HCO3)2溶液中,NaOH不足,则发生HCO3-+Ca2++OH-═CaCO3↓+H2O,若NaOH过量,
则发生2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,以此来解答.
解:NaOH、Ca(HCO3)2均为强电解质,
①若NaOH少量,滴入Ca(HCO3)2溶液中,NaOH完全反应,则离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,
②若NaOH过量,滴入Ca(HCO3)2溶液中,Ca(HCO3)2完全反应,则离子反应为
2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,
故选BD.
本题难度:一般
5、填空题 【化学——选修2:化学与技术】(15分)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
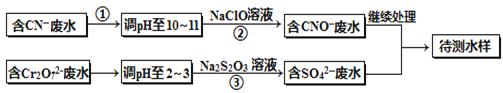
(1)上述处理废水流程中主要使用的方法是_________________;
(2)②中反应后无气体放出,该反应的离子方程式为______________;
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应的离子方程式为?;
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因?;
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于: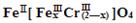 (铁氧磁体,罗马数字表示元素价态)的沉淀。
(铁氧磁体,罗马数字表示元素价态)的沉淀。
处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
A.x ="0.5" ,a ="8"
B.x ="0.5" ,a =" 10"
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
参考答案:
(1)氧化还原法。(2)CN-+ClO-=CNO-+Cl-(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓? Cu(OH)2(s) +S2-(aq) =CuS(s) +2OH-(aq)
因为Ksp(CuS)<Ksp〔Cu(OH)2〕(5)D
本题解析:(1)氧化还原法。含有CN-的加入氧化剂,含有Cr2O72-离子的加入还原剂。
(2)CN-+ClO-=CNO-+Cl-
(3)每处理0.4mol Cr2O72-时转移电子2.4mol,表明1mol Cr2O72-时转移电子6mol,因此有如下转化关系:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓? Cu(OH)2(s) +S2-(aq) =CuS(s) +2OH-(aq)
因为Ksp(CuS)<Ksp〔Cu(OH)2〕
(5)依据化合物化合价的代数和为零,以及氧化还原反应中得失电子相等可知选项为D。
本题难度:简单