微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下,在pH=12的某碱溶液中,由水电离的c(OH-)为(? )
A.1.0×10-7 mol·L-1
B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1
D.1.0×10-12 mol·L-1
参考答案:D
本题解析:由于是碱溶液,pH=12也即水电离出的c(H+)=1×10-12 mol·L-1。水电离的c(H+)=c(OH-),故由水电离出的c(OH-)也为1×10-12 mol·L-1。
本题难度:简单
2、选择题 在碱性溶液中,下列各项中的离子可以大量共存的是?
A.Fe3+、Cu2+、Cl—、NO3—
B.K+、NO3—、Ag+、Cl—
C.Na+、SO42—、K+、Cl—
D.Ca2+、MnO4—、Na+、CO32—
参考答案:C
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。溶液显碱性,则.Fe3+、Cu2+不能大量共存,A不正确;B中Ag+、Cl—,D中的Ca2+、CO32—均不能大量共存,所以正确的答案选C。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
3、填空题 为防止环境污染和发生意外事故,实验过程中产生的废液不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以采用的试剂是 。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是
。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的 和 (填物质名称),充分反应后,经过 (填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
参考答案: (1)HCl(或盐酸盐) 有白色沉淀生成 (2)铁粉(或比铜活泼的金属) 稀盐酸 过滤
本题解析:(1)利用Ag+和Cl-反应生成不溶于稀硝酸或盐酸的AgCl白色沉淀来检验Ag+。
(2)回收Cu、Ag两种金属的流程如下:
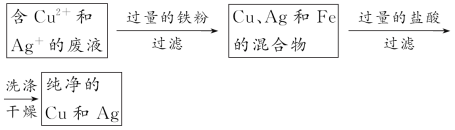
考点:常见物质的检验、分离和提纯
本题难度:一般
4、选择题 下列各组离子一定能大量共存的是
A.由水电离出的c(H+)=1×10-14mol/L的溶液中: K+、I-、Cl-、NO3-
B.在呈中性的溶液中:Al3+、Na+、CO32—、Cl—
C.在pH=12的溶液中NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1 mol·L-1的溶液中Fe3+、K+、Cl-、NO3-