|
高考化学必考知识点《无机综合与推断》考点强化练习(2017年押题版)(二)
2017-08-06 08:51:57
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
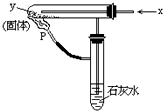
1、选择题 按右图装置持续通入x气体,并在管口P处点燃,实验结果使澄清的石灰水变浑浊.则x、y可以是( )
A.H2和NaHCO3
B.CO和Na2CO3
C.CO和CuO
D.H2和Fe2O3
| 
参考答案:AC
本题解析:
本题难度:一般
2、填空题 V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:

(1)W的原子结构示意图为?;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为?;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:

若E为白色沉淀,则E物质的化学式为?;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n]?(填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a?b(填“>"或“<”或“=”)。
参考答案:(15分)(1) 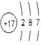 ?(2分) ?(2分)
(2)4Al? + 3 TiO2? +3C 2 Al2O3+3TiC? (3分)? 2 Al2O3+3TiC? (3分)?
(3)Al(OH)3?(2分)
(4)>(2分)
(5)2C2H2 (g)+5O2(g) ==4CO2(g)+2H2O(l)?△H=-2589.6kJ/mol (3分)
(6) >(3分)
本题解析:(1)由题意可知,V、W、X、Y分别为氮、氯、铝、碳,M、N分别是氨气和氯化氢,Z是铁,氯原子核电荷数为+17,核外电子层结构为287;(2)铝由0价升为+3价,碳由0价将为—4价,由电子、原子守恒配平,该氧化还原反应方程式为4Al+3TiO2+3C 2Al2O3+3TiC;(3)碳酸的酸性比氢氧化铝强,由题意可知,该反应式为NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3;(4)由题意可知,优先生成溶解度较小的沉淀,则Ksp[X(OH)n]>Ksp[Z(OH)n];(5)由m/M可知,n(C2H2)=1/13mol,由题意可知,1/13C2H2(g)+5/26O2(g)==2/13CO2(g)+1/13H2O(l)?△H=—99.6kJ?mol—1,或2C2H2 (g)+5O2(g) ==4CO2(g)+2H2O(l)?△H=-2589.6kJ/mol;(6)若a=b,则NH3与HCl恰好反应生成NH4Cl,NH4Cl中NH4+水解导致所得溶液呈酸性,要使所得溶液的pH=7,则氨气一定过量,得到氨水和氯化铵的混合溶液,则a>b。 2Al2O3+3TiC;(3)碳酸的酸性比氢氧化铝强,由题意可知,该反应式为NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3;(4)由题意可知,优先生成溶解度较小的沉淀,则Ksp[X(OH)n]>Ksp[Z(OH)n];(5)由m/M可知,n(C2H2)=1/13mol,由题意可知,1/13C2H2(g)+5/26O2(g)==2/13CO2(g)+1/13H2O(l)?△H=—99.6kJ?mol—1,或2C2H2 (g)+5O2(g) ==4CO2(g)+2H2O(l)?△H=-2589.6kJ/mol;(6)若a=b,则NH3与HCl恰好反应生成NH4Cl,NH4Cl中NH4+水解导致所得溶液呈酸性,要使所得溶液的pH=7,则氨气一定过量,得到氨水和氯化铵的混合溶液,则a>b。
本题难度:一般
3、填空题 [化学——选修物质结构与性质](15分)
A、B、C、D是原子序数依次递增的短周期元素,四种元素的质子数之和小于23。
A元素原子的电子总数等于其基态原子的电子层数。B元素原子的价电子结构为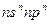 。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但 。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
其单质的熔点却低于同周期左右相邻元素的单质。D的电负性大于C。
(1)B、C、D分别是?、?、?;
(2)C、D分别与A形成的最简单分子中,稳定性较高的是?(填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会发生改变,其原因是?。
(3)BD2分子的晶体结构为密堆积,则每个BD2分子周围紧邻的分子有?个;
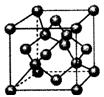
(4)上图为B元素的某种单质晶体X的晶胞,其中含有?个B原子,该晶体?
(填“形成”或“没有形成”)最密堆积结构,原因是?。试分析比较晶体X与晶体BD2的熔点?。
参考答案:
(1)C、N、O(或碳、氮、氧)(每空1分)
(2)H2O(1分);H2O呈V形(键角约104.5°),H2O与H′形成配位键后,氧原子上
的孤对电子由两对变为一对,H—O——H的键角变大,H3O+呈三角锥形(或用杂化轨
道理解释)(2分)
(3)12(2分)
(4)8(2分);没有形成(1分);金刚石中每个碳原子以四个共价单键对称的与相邻的4个碳原子结合,C—C—C夹角为109°28′,形成空间网状结构(或答共价键具有方向性和饱和性)(2分);金刚石晶体是原子晶体,由固态转变为液态过程中要破坏共价键,所以熔点较高,干冰是分子晶体,由固态转变成液态过程中只破坏范德华力,所以熔点较低(2分)
本题解析:略
本题难度:一般
4、填空题 有一无色溶液,含有Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的许多种.取该溶液进行如下实验:
①取适量溶液,加入过量盐酸,有气体生成,并得到溶液.
②在①所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲.
③在②所得溶液中加入过量浓Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出.
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是______;
(2)一定存在的离子是______;
(3)判断沉淀乙成分的方法是______.
参考答案:(1)、根据无色溶液,确定不会MnO4-.加入过量盐酸,有气体生成,确定含CO32-,CO32-与Ag+、Ba2+、Al3+反应产生沉淀,无色溶液,
故答案为:Ag+、Ba2+、Al3+、MnO4-
(2)、在①所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲,①中过量盐酸与碳酸氢铵反应,NH4HCO3+HCl=NH4Cl+H2O+CO2↑,
过量的碳酸氢铵溶液与某离子反应有沉淀生成,只能是AlO2-与HCl反应得到的Al3+,故含有AlO2-
故答案为:CO32-,AlO2-
(3)、在②所得溶液中加入过量浓Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出,②中剩余的碳酸氢铵溶液与
Ba(OH)2溶液反应,NH4HCO3+Ba(OH)2=BaCO3↓+NH3↑+2H2O,
SO42-与Ba(OH)2溶液也反应,SO42-+Ba(OH)2=BaSO4↓+2OH-
故白色沉淀乙可能是BaCO3或BaSO4或BaCO3和BaSO4
BaCO3和盐酸反应,所以向BaCO3中滴加盐酸,沉淀会减少.BaSO4和盐酸不反应,所以向BaSO4中滴加盐酸,沉淀无变化,所以可用盐酸检验沉淀是哪种物质.
故答案为:取白色沉淀乙加入稀盐酸.若完全溶解则为BaCO3,若完全不溶解则为BaSO4,
若部分溶解则为BaCO3与BaSO4的混合物.
本题解析:
本题难度:一般
5、推断题 已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

请回答下列问题:
(1)组成B单质的元素位于周期表第_____周期,第_____族。化合物C的电子式为__________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
参考答案:(1)三;II A ;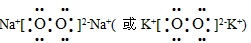
(2)水分子之间存在氢键且比硒化氢的分子间作用力强
(3)4NH3+3O2 2N2+6H2O? 2N2+6H2O?
(4)Mg3N2+8HNO3===3Mg(NO3)2+2NH4NO3
(5)2
本题解析:
本题难度:一般
| 