微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质( )
A.立刻褪色
B.慢慢褪色
C.先褪色,后复原
D.颜色不褪
参考答案:虽SO2和Cl2都具有漂白性,
但等物质的量的这两种气体同时作用于潮湿的有色物质,
发生SO2+Cl2+2H2O═H2SO4+2HCl,
硫酸与盐酸都不具有漂白性,
则不能使有色的物质褪色,
故选D.
本题解析:
本题难度:一般
2、选择题 下列关于卤素(用X表示)叙述正确的是
A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐升高
B.单质和水反应通式是:X2 + H2O=HX + HXO,剧烈程度随着核电荷数的增多而减弱。
C.单质和氢气反应的通式是:X2 + H2= 2HX(条件不同),剧烈程度随着卤素核电荷数的增多而减弱,所生成的氢化物的稳定性降低
D.随着卤素核电荷数的增多,单质的氧化性逐渐增强,阴离子还原性逐渐减弱
参考答案:AC
本题解析:A正确,B不正确,单质氟和水反应生成HF和氧气;同主族自上而下非金属性逐渐降低,氢化物的稳定性逐渐减弱,C正确;随着卤素核电荷数的增多,单质的氧化性逐渐减弱,阴离子还原性逐渐增强,D不正确,答案选AC。
点评:该题是中等难度的试题,试题紧扣教材,主要是考查学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力,提高学生分析、归纳、总结问题的能力,提升学生的学科素养。
本题难度:一般
3、选择题 实验室常用下列三个反应制备Cl2:①MnO2?与浓盐酸反应制备氯气;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2?+8H2O;?③KClO3+6HCl(浓)=KCl+3Cl2?+3H2O如果分别用上述方法制得等量的Cl2,下列说法中正确的是? ( ?)
A.参加反应的HCl的物质的量相等
B.转移电子的总数相等
C.消耗氧化剂的物质的量相等
D.被氧化的氯离子数不相等
参考答案:D
本题解析:A错,MnO2?与浓盐酸反应制备氯气方程式为: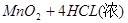 ====
====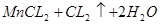 ;每生成1mol氯气参加反应的HCL的物质的量为4mol;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2?+8H2O;每生成1mol氯气参加反应的HCL的物质的量为3.2mol;③KClO3+6HCl(浓)=KCl+3Cl2?+3H2O;每生成1mol氯气参加反应的HCL的物质的量为2mol;
;每生成1mol氯气参加反应的HCL的物质的量为4mol;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2?+8H2O;每生成1mol氯气参加反应的HCL的物质的量为3.2mol;③KClO3+6HCl(浓)=KCl+3Cl2?+3H2O;每生成1mol氯气参加反应的HCL的物质的量为2mol;
B错,反应①中每生成1mol氯气转移的电子总数为2mol;反应②中每生成1mol氯气转移的电子总数为2mol;反应③中中每生成1mol氯气转移的电子总数为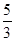 mol;C错,反应①中每生成1mol氯气消耗氧化剂MnO2?的物质的量为1mol;反应②中每生成1mol氯气消耗氧化剂KMnO4的物质的量为0.4mol;反应③中中每生成1mol氯气消耗氧化剂KClO3的物质的量为
mol;C错,反应①中每生成1mol氯气消耗氧化剂MnO2?的物质的量为1mol;反应②中每生成1mol氯气消耗氧化剂KMnO4的物质的量为0.4mol;反应③中中每生成1mol氯气消耗氧化剂KClO3的物质的量为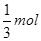 ;D正确;
;D正确;
本题难度:一般
4、选择题 根据氯元素在下列物质中的化合价,判断下列说法中错误的是(? )
A.Cl2既具有氧化性又具有还原性
B.Cl-具有还原性
C.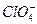 只具有氧化性
只具有氧化性
D.ClO-只具有氧化性
参考答案:D
本题解析:Cl元素的化合价有-1,0,+1,+3,+5,+7六种。ClO-中Cl为+1价,是中间价态,故也有还原性。
本题难度:简单
5、选择题 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

下列说法正确的是( )
A.苛性钾溶液中KOH的质量是4.94 g
B.反应中转移电子的物质的量是0.09 mol
C.氧化性ClO-<ClO
D.ClO的生成是由于温度升高引起的
参考答案:D
本题解析:Cl2通入一定浓度的苛性钾溶液中生成了ClO-和ClO两种离子,CL元素的化合价升高,即还要生成CL—,根据氧化还原反应过程中得失电子数相等可得 ,根据电荷守恒,得
,根据电荷守恒,得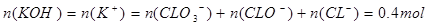 ,A错,
,A错,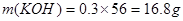 ;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
本题难度:困难