微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度下,在2 L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。
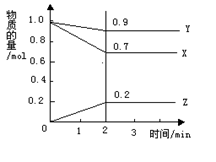
由图中数据分析:该反应的化学方程式为:?。反应开始至2 min ,Z的平均反应速率为?。
参考答案:3X+Y 2Z;0.05mol/(L·min)
2Z;0.05mol/(L·min)
本题解析:本题考查化学反应速率的计算及化学方程式的书写,化学反应中生成物或反应物的物质的量的变化按化学方程式中的系数比进行的,这是解题的关键。同时处理图象题,要弄明白两坐标的意义及数值的确定和单位的换算等。依据图象可知,X、Y的浓度减小,说明它是反应物;Z浓度增加,说明它是生成物,且同一化学反应方程式中不同反应混合物前的化学计量数与对应的各物质所表示反应速率成正比,与对应的各物质的物质的量的改变成正比,故方程式为:3X+Y 2Z;又依据图象可知,Z的物质的量增加了0.2mol,用去时间2 min,则υ(Z)=0.05mol/(L·min)。
2Z;又依据图象可知,Z的物质的量增加了0.2mol,用去时间2 min,则υ(Z)=0.05mol/(L·min)。
本题难度:简单
2、选择题 下列示意图中,正确的是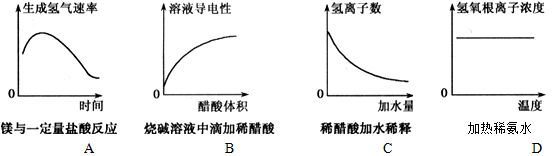
参考答案:A
本题解析:略
本题难度:一般
3、填空题 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g)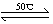 ?Ni(CO)4(g)+Q
?Ni(CO)4(g)+Q
(2)Ni(CO)4(g)  Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 ?、??。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为??。

(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时??。
a.平衡常数K增大? b.CO的浓度减小
c.Ni的质量减小?d.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
参考答案:
(1)及时移走Ni(CO)4,加压。
(2)0.05mol·L-min-。
(3)bc。
(4)先将粗镍和CO在50℃反应生成羰基镍,然后将羰基镍转移到另外一个中,升温至230℃热解得到纯镍。
本题解析:
(1)反应(1)是正向气体体积缩小的放热反应,因此根据平衡移动原理在温度不变的情况下采取可增大CO浓度,及时移走Ni(CO)4,加压的方法等提高产率;
(2)根据题意,反应的Ni为1 mol,则生成Ni(CO)4为1 mol,反应速率为1/(2×10)=0.05mol·L-min-;
(3)反应(2)是正向气体体积增大的吸热反应,则,降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆【Ni(CO)4】均减小;根据反应⑴⑵的特点可提纯粗镍。
【考点定位】 本题考查化学反应速率、平衡移动原理的应用。
本题难度:一般
4、选择题 已知在某条件下O2的密度为1.28 g·L-1。在实验室用KClO3制O2,生成O2的平均速率为0.01 mol·L-1·min-1,则要制取500 mL O2,需要的时间为(?)
A.1 min
B.2 min
C.3 min
D.4 min
参考答案:B
本题解析:O2在该状态下的密度为1.28 g·L-1,所以该温度、压强下,1 L O2的质量为1.28 g。要制取500 mL O2,则质量为:
 ="0.64" g
="0.64" g
n(O2)=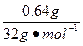 ="0.02" mol
="0.02" mol
c(O2)=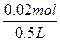 ="0.04" mol·L-1
="0.04" mol·L-1
t=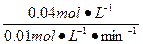 ="4" min
="4" min
即生成1 L O2耗时4 min,生成500 mL O2耗时2 min。
本题难度:简单
5、选择题 某温度下,密闭容器中发生反应aX(g) 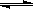 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是?
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是?
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
参考答案:C
本题解析:恒温下,体积缩小为原来的一半,假设原反应的平衡不移动,则物质Y和Z的浓度将均增加至原来的2倍,而实际上Y、Z的浓度均为原来的1.8倍,说明平衡向逆反应方向移动,因而X的转化率减小,Z的质量分数减小。因体积减小(即压强增大),正、逆反应速率均增大,且化学平衡是向着气体物质的物质的量减少的方向移动,有a<b+c。[点拨]如果已知压强改变后浓度变化情况,可先看平衡不移动时压强改变后浓度应该变化, 再由实际情况即可确定压强对平衡的影响。
本题难度:简单