| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《离子方程式的书写及正误判断》试题特训(2017年最新版)(六)
参考答案:C 本题解析:A.醋酸是弱酸,应该写化学式,离子方程式是:CaCO3+2CH3COOH==Ca2++2CH3COO -+H2O+CO2↑,错误;B.不符合物质的组成,向FeBr2溶液中通入足量C12,反应的离子方程式是:2Fe2++4Br一+3C12==2Fe3++2Br2+6C1一,错误;C.符合反应事实,拆符合离子方程式的原则,正确;D.不符合微粒的个数比例关系,向Ba(OH)2溶液滴加NaHSO4溶液至中性的离子方程式是:2H++SO42-+Ba2++2OH一==BaSO4↓+2H2O,错误。 本题难度:困难 2、选择题 下列反应的离子方程式正确的是 ( ) |
参考答案:B
本题解析:解题的关键是根据离子反应条件找出参加反应的离子,然后再根据离子的来源判断书写的正误。A选项中应注明生或物Fe(OH)3为胶体,A不正确,B正确;C、D两选项电荷不守恒,皆不正确。
本题难度:一般
3、填空题 (12分)⑴写出下列物质的电离方程式:
①CuCl2 ②Na HCO3
HCO3
③KHSO4
⑵按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②硫酸镁溶液中滴加氢氧化钡溶液
⑶写出与离子反应方程式CO2+2OH-=CO32-+H2O所对应的其中一个化学方程式
参考答案: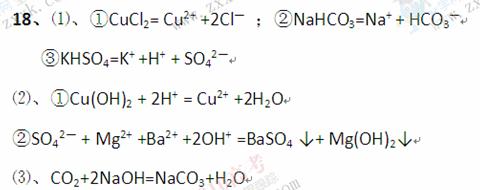
本题解析:略
本题难度:一般
4、填空题 2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
参考答案:(1)1、5、8、1、5、4
(2)0.007
(3)19.6
(4)40%
本题解析:(2)设消耗高锰酸钾xmol,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol/L
所以x=0.007。剩余KMnO4的物质的量为0.007mol。
(3)设(NH4)2Fe(SO4)2?6H2O 的物质的量为ymol,
(NH4)2Fe(SO4)2?6H2O---- Fe2+
1mol 1mol
ymol 0.500L×0.1mol/L
y=0.05,
所以其质量为m=nM=0.05mol×392g/mol=19.6g;
故答案为:19.6g。
(4)设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+44H++5Cu2S=10Cu2++5SO2+8Mn2++22H2O
8 5
8m/5mol mmol
6MnO4-+28H++5CuS=5Cu2++5SO2+6Mn2++14H2O
6 5
6n/5mol nmol
所以列方程组为:160mg+96ng=2g,8m/5mo+6n/5mol,解得m=0.005,n=0.0125。
所以Cu2S的质量为0.8g,CuS的质量为1.2g,
Cu2S的质量分数为0.8g÷2g×100%=40%,
故答案为:40%
考点:离子方程式的有关计算
点评:本题考查了离子方程式的有关计算,难度较大,易错题是(2),注意铵根离子和(NH4)2Fe(SO4)2的关系式,根据铵根离子计算(NH4)2Fe(SO4)2的质量。
本题难度:一般
5、选择题 下列离子反应方程书写正确的是
A.H2O + H2O 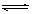 H3O+ + OH—
H3O+ + OH—
B.CO32—+ 2H2O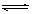 H2CO3 + 2OH—
H2CO3 + 2OH—
C.Ca(OH)2 + 2H+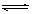 Ca2+ + 2H2O
Ca2+ + 2H2O
D.Al3++3H2O == Al(OH)3↓+ 3H+
参考答案:A
本题解析:A. H2O + H2O 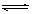 H3O+ + OH—正确;B. 多元弱酸分别水解,应为CO32—+ H2O
H3O+ + OH—正确;B. 多元弱酸分别水解,应为CO32—+ H2O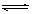 HCO3 -+ OH—,错误;C. Ca(OH)2 + 2H+==Ca2+ + 2H2O,错误; D. Al3++3H2O
HCO3 -+ OH—,错误;C. Ca(OH)2 + 2H+==Ca2+ + 2H2O,错误; D. Al3++3H2O 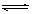 Al(OH)3 + 3H+,错误;选A。
Al(OH)3 + 3H+,错误;选A。
考点:考查离子反应方程式的正误判断。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《气体的制备.. | |