微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
参考答案:C
本题解析:NaHSO3溶液和NaHCO3溶液中存在①溶质电离:NaHRO3=Na++HRO3-,②HRO3-电离:HRO3- H++RO32-,③HRO3-水解:HRO3-+H2O
H++RO32-,③HRO3-水解:HRO3-+H2O H2RO3+OH-,④水电离:H2O
H2RO3+OH-,④水电离:H2O H++OH-。溶液的电荷守恒式(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);物料守恒式(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);(a)-(b)得质子守恒式(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-)。A、NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解程度大于电离程度,c(OH-)>c(H+),错误;B、根据电荷守恒式c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),错误;C、根据质子守恒式c(H+)+c(H2RO3)=c(RO32-)+c(OH-),正确;D、根据物料守恒式c(Na+)=c(HRO3-)+(H2RO3)+c(RO32-),错误。
H++OH-。溶液的电荷守恒式(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);物料守恒式(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);(a)-(b)得质子守恒式(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-)。A、NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解程度大于电离程度,c(OH-)>c(H+),错误;B、根据电荷守恒式c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),错误;C、根据质子守恒式c(H+)+c(H2RO3)=c(RO32-)+c(OH-),正确;D、根据物料守恒式c(Na+)=c(HRO3-)+(H2RO3)+c(RO32-),错误。
本题难度:一般
2、选择题 下列各组数据关系中,前者比后者大的是(?)
A.常温常压下,pH =10的KOH溶液和pH=" 10" 的CH3COOK溶液中,由水电离的OH -浓度
B.纯水在100 0C和20℃时pH
C.25℃,浓度相同的硅酸钠溶液与碳酸钠溶液的pH
D.l0mL mol·L-1醋酸溶液稀释10倍,稀释前后的H+数目
参考答案:C
本题解析:略
本题难度:简单
3、选择题 常温下,下列各溶液中微粒的物质的量浓度关系正确的是
①c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:
c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl)
②向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
④某二元弱酸的酸式盐NaHA溶液中
c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
⑤将pH=6的H2SO4稀释1000倍后,c(H+)=200c(SO42-)
A.①②
B.③⑤
C.④⑤
D.②④
参考答案:B
本题解析:硫酸氢铵溶于水电离出氢离子,抑制NH4+水解,所以①不正确,应该是c(NH4Cl)>c(NH4HSO4) > c[(NH4)2SO4];根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因此②不正确;③正确,符合质子守恒;④不正确,应该是c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-);pH=6的H2SO4稀释1000倍后,pH=7,而c(SO42-)=10-6/2000,所以c(H+)=200c(SO42-),⑤正确,答案选B。
点评:在比较溶液中离子浓度大小时,应该注意利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒都能够。另外还需要注意的是如果酸无限稀释时,其pH不可能超过7,只能时趋近于7。
本题难度:一般
4、选择题 一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O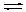 CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A.加入少量NaOH固体,c(CH3COO-)增大
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量醋酸得到的酸性混合溶液:c (Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:AB
本题解析:略
本题难度:简单
5、选择题 下列叙述正确的是
A.将一定体积醋酸溶液加水至原来体积的m倍,则pH增大m
B.250C, pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在: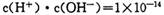
C 250C, pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c (0H_)不相等
D.在NaHCO3溶液中:
参考答案:B
本题解析:本题考查水溶液的离子平衡的有关知识。醋酸是弱酸,在加水稀释过程中,继续电离,产生更多的氢离子,则pH增大小于lgm倍,A错;水的离子常数只与温度有关,与溶液中的氢离子或氢氧根离子浓度大小无关,温度不变,水的离子积就不变,250C时为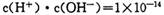 ,B正确;在水中加碱抑制水的电离,pH=8的NaOH溶液和pH=8的氨水中,OH-浓度相等,抑制程度相同,故由水电离出的c (0H_)相等,C错;在NaHCO3溶液中,HCO3-进入溶液后,将以三种形式存在,即HCO3-、CO32-、H2CO3,则溶液中的物料守恒表达式应为c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),故D错。
,B正确;在水中加碱抑制水的电离,pH=8的NaOH溶液和pH=8的氨水中,OH-浓度相等,抑制程度相同,故由水电离出的c (0H_)相等,C错;在NaHCO3溶液中,HCO3-进入溶液后,将以三种形式存在,即HCO3-、CO32-、H2CO3,则溶液中的物料守恒表达式应为c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),故D错。
本题难度:一般