微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 具有下列电子构型的元素中,第一电离能最小的是(?)
A.ns2np3
B.ns2np5
C.ns2np6
D.ns2np4
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列各物质的主要成分,皆为同一酸所对应的盐的是
A.大理石、重晶石、光卤石
B.小苏打、苏打、大苏打
C.绿矾、蓝矾、明矾
D.铝土矿、硫铁矿、磁铁矿
参考答案:C
本题解析:A项,大理石的主要成分是碳酸钙,重晶石的主要成分是硫酸钡,光卤石是镁和钾的氯化物,错误;B项,小苏打和苏打都是碳酸盐,大苏打的主要成分是硫代硫酸钠;C项,三者都是硫酸盐;铝土矿和磁铁矿都是金属氧化物,硫铁矿是铁的硫化物.
本题难度:简单
3、填空题 (10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
?
| IA
| ⅡA
| ⅢA
| ⅣA
| VA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ⑥
| ?
| ⑦
| ?
| ?
|
3
| ①
| ③
| ⑤
| ?
| ?
| ?
| ⑧
| ⑩
|
4
| ②
| ④
| ?
| ?
| ?
| ?
| ⑨
| ?
|
(1)10种元素中,化学性质最不活泼的是__________(填元素名称)。
(2)在①②⑤的最高价氧化物的水化物中,碱性最强的是__________(填化学式)。
(3)元素⑦的常见的氢化物的化学式为__?__,该氢化物常温下和元素②的单质反应的离子方程式是:_______________________,该氢化物与元素⑧的单质反应的离子方程式是___________________________。
(4)①和⑨的最高价氧化物对应的水化物化学式分别为___________和_______。
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为__________________
(6)⑧与⑨分别与H2形成的氢化物的稳定性:__________,(用化学式表示)最高价氧化物对应的水溶液的酸性:_______________。(用化学式)
参考答案:(1)氩(2)KOH(3)H2O;2K+2H2O==2K++2OH―+H2↑;Cl2+H2O H++Cl―+HClO
H++Cl―+HClO
NaOH;HBrO4?(5)NaOH+Al(OH)3==NaAlO2+2H2O
(6) HCl>HBr;HClO4>HBrO4
本题解析:(1)零族元素最外层达到了稳定结构,化学性质稳定;(2)同主族最高价氧化物对应水化物碱性逐渐增强,同周期最高价氧化物对应水化物碱性逐渐减弱,故KOH>NaOH>Al(OH)3;(3)元素⑦为O,故氢化物为H2O;钾和水反应生成氢氧化钾和氢气;元素⑧为氯,氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,不能写成离子形式;(4)①为钠,钠的最高价氧化物对应的水化物为NaOH,⑨为溴,溴的最高价氧化物对应水化物为高溴酸,即HBrO4;(5)氢氧化钠和氢氧化铝反应的方程式;(6)同主族气态氢化物的稳定性逐渐减弱,故HCl>HBr,最高价氧化物对应水化物的酸性逐渐减弱,故HClO4>HBrO4
本题难度:一般
4、选择题 四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )。
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
A.只有③
B.①②③④
C.①②③
D.②③
参考答案:D
本题解析:由题意知,a-m=b-n=c+n=d+m,又m >n,则①错误,②正确。主族元素简单阳离子所带的正电荷数为其族序数,阴离子所带的负电荷数为8-族序数,故Z、R位于X、Y的上一周期,且Z在R后,X在Y后,故③正确,④错误。综上所述,D正确。
本题难度:一般
5、填空题 Ⅰ.某元素有6个电子处于第三电子层d轨道上,推测该元素的原子序数是________,并根据洪特规则推测在第三电子层d轨道上未成对电子的个数是________个。
Ⅱ.核电荷数小于18的两种元素,A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个,则:
(1)写出元素的名称和符号:A.____________________,B.____________________。
(2)写出各原子的核外电子排布的轨道表示式。
参考答案:Ⅰ.26 4
Ⅱ.(1)氧元素、O 硅元素、Si
(2)O: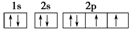 ? Si:
? Si: 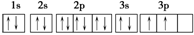
本题解析:Ⅰ.由于3d轨道上有6个电子,说明该元素原子的电子排布式为1s22s22p63s23p63d64s2,即为Fe元素,根据洪特规则“电子尽量分布在不同的轨道上且ms相同”,判断3d上有4个未成对电子。Ⅱ.根据B原子L层电子数为(a+b)个,判断a+b=8,说明b<8,那么A原子次外层电子数为b个,b只能为2,那么a=6,推测A为O,B为Si。
本题难度:一般