微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E、F六种元素的原子序数依次递增。
已知:①F的原子序数为25,其余的均为短周期元素;②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三种原子p轨道上均有2个未成对电子;③元素C、D、E在同一周期,且C原子中没有未成对电子。
请回答下列问题:
(1)元素A与元素B的电负性大小比较为:________>________;元素C与元素D的第一电离能的大小比较为:________>________(填入相应的元素符号)
(2)F的核外电子排布式为________。
(3)元素B与元素E形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(4)由氢元素与A、B两元素共同构成的相对分子质量为30的分子里,中心原子的杂化轨道类型为________,分子的空间构型为________.
(5)根据等电子原理,写出由元素A与元素B构成的一种双原子极性分子的结构式:________。
参考答案:(1)O;C;Mg;Al (2)[Ar]3d54s2(或1s22s22p63s23p63d54s2) (3)原子;A (4)sp2;平面三角形 (5)C≡O
本题解析:A、B是第二周期元素,C、D、E是第三周期元素。由题意,A原子的电子排布式为1s22s22p2,B原子的电子排布式为1s22s22p4;C原子中没有未成对电子,则C原子的电子排布式为1s22s22p63s2,所以A是C(碳),B是O,C是Mg,D是Al,E是Si。(1)电负性O>C。因为Mg原子3s轨道上排满了2个电子,3p轨道上没有电子,Al的3p轨道上有1个电子,所以Mg的第一电离能比Al的第一电离能大。(2)F是25Mn,因为能级交错,E(3d)>E(4s),其核外电子排布式为1s22s22p63s23p63d54s2。(3)SiO2晶体是原子晶体,Si—O键是单键,单键是σ键。(4)该物质是甲醛(HCHO),甲醛是平面三角形结构,C原子以sp2的方式杂化。(5)CO与N2是等电子体,结构相似,CO是极性分子,分子中间的化学键是三键。
本题难度:一般
2、选择题 下列有关化学用语或名称表达正确的是
[? ]
A.亚硫酸的电离方程式:H2SO3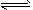 2H++SO32-
2H++SO32-
B.乙炔的分子结构模型示意图: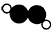
C.H2O2的电子式:
D.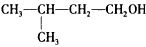 的名称:3 -甲基-1 -丁醇
的名称:3 -甲基-1 -丁醇
参考答案:D
本题解析:
本题难度:简单
3、简答题 有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为______.
(2)可以比较D和F得电子能力强弱的是______(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______;并写出其中阳离子的电子式______.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式______.
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.
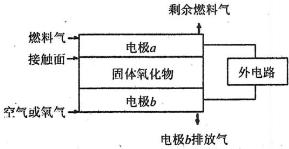
①固体氧化物中的O2-向______(填“正”或“负”)极移动.
②电极b为电池______极,其电极反应式为______.
③若A2作为燃料气,则接触面上发生的反应为______.
④若B2A4作为燃料气,则接触面上发生的反应为______.
参考答案:有原子序数依次增大的A、B、C、D、E、F六种短周期元素,A元素的原子半径是所有元素中原子最小的,所以A为H元素;C元素的最高价氧化物对应水化物与其氢化物能生成盐M,则C是N元素;E与A同主族,且与E同周期,E的原子序数大于C,所以E为Na元素;F元素原子的最外层电子数比次外层电子数少2,则F为S元素;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物,则D为O元素,B为C元素,
(1)通过以上分析知,D是O元素,O元素位于第二周期第VIA族,故答案为:第二周期第VIA族;
(2)比较D和F得电子能力强弱实际上就是比较两种元素的非金属性强弱,比较非金属性强弱的方法有:比较与氢气化合的难易程度、比较氢化物的稳定性、比较两种元素形成的化合物中的化合价、电负性等,故选bc;
(3)硝酸铵中 铵根离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子、硝酸根离子中氮原子和氧原子之间都存在共价键,铵根离子的电子式为:
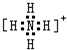
,故答案为:离子键、共价键;
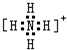
;
(4)1molNa与水反应放出283.5kJ的热量,则2molNa与水反应放出567kJ热量,所以其热化学反应方程式为
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol,
故答案为:2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol;
(5)①原电池放电时阴离子向负极移动,所以O2-向负极移动,故答案为:负;
②燃料电池中,正极上投放氧化剂,所以b电极是正极,正极上氧气得电子生成氧离子,所以电极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
③如果氢气为燃料,则该电极上氢气失电子和氧离子反应生成水,则电极反应式为H2+O2--2e-=H2O,故答案为:H2+O2--2e-=H2O;
④如果C2H4作为燃料气,该电极上燃料失电子和氧离子反应生成二氧化碳和水,所以电极反应式为C2H4+6O2--12e-=2CO2+2H2O,
故答案为:C2H4+6O2--12e-=2CO2+2H2O.
本题解析:
本题难度:一般
4、选择题 元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是( )
A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
B.某微粒的结构示意简图为
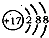
,则该元素在周期表中位于第三周期、VIA族
C.Be(OH)2的碱性比Mg(OH)2的碱性强
D.原子半径:Na>Si>O
参考答案:A.元素周期表中位于金属和非金属分界线附近的元素属于半导体元素,过渡元素在副族和第VIII族中,故A错误;
B.该微粒是Cl-,氯元素原子核外有17个电子,所以氯元素在第三周期第VIIA族,故B错误;
C.Mg的金属性比Be强,所以Be(OH)2的碱性比Mg(OH)2的碱性弱,故C错误;
D.钠、硅有3个电子层,氧原子有2个电子层,钠的原子序数小于硅,所以原子半径大小顺序是Na>Si>O,故D正确;
故选D.
本题解析:
本题难度:简单
5、填空题 (10分)(1)(6分)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是:?其反应的离子方程式为:?.?
(2)(4分)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为?和??。其中心原子的杂化方式分别是?和?
参考答案:(1)(6分)形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。(2分)? Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O(2分)
(2)(4分)平面三角形?三角锥形? sp2? sp3?(各1分)
本题解析:(1)硫酸铜和氨水反应生成蓝色的氢氧化铜沉淀,但氨水过量时,氢氧化铜能溶解在氨水中形成配合物,是由现象是形成蓝色沉淀,继续添加氨水蓝色沉淀溶解,得到深蓝色的透明溶液。离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+、
Cu(OH)2+4NH3?H2O="[" Cu(NH3)4] 2++2OH-+4H2O。
(2)CO32-和SO32-的中心原子含有的孤对电子分别是(4+2-2×3)÷2=0、(6+2-2×3)÷2=1,是由前者是平面三角形,后者三角锥形。因此中心原子的杂化类型分别是sp2杂化和sp3杂化。
本题难度:一般