微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在无色溶液中,下列离子能大量共存的是:
A.NH4+、Na+、S2-、ClO-
B.K +、SO42-、OH-、AlO2-
C.K +、Fe3+ 、Cl-、NO3-
D.Ba2+ 、Na+ 、OH-、CO32-
参考答案:B
本题解析:A. S2-、ClO-发生氧化还原反应,不能大量共存;B.能大量共存
C. Fe3+ 是黄色的溶液,不是无色溶液; D.Ba2+、CO32-生成BaCO3沉淀。选B。
本题难度:一般
2、选择题 常温下,向含2 mol NaClO的稀溶液中通入1 mol CO2二氧化碳,充分反应后,生成1 mol HClO和1 mol NaHCO3,
经检验溶液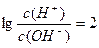 .有关反应后该混合溶液的叙述正确的是
.有关反应后该混合溶液的叙述正确的是
A.上述反应对应的离子方程式为2ClO-+CO2+H2O=2HClO+CO32-
B.上述溶液中:c(ClO-)>c(HCO3-)>c(CO32-)
C.上述溶液中:c(ClO-)+c(HClO)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.上述溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(ClO-)
参考答案:
B
本题解析:
从题干信息可看出,电离H+能力:H2CO3>HClO>HCO3-,离子方程式为ClO-+CO2+H2O=HClO+HCO3-,A选项错误;反应后的溶液中含有1 mol NaClO、1mol HClO、1mol NaHCO3,由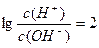
得c(H+)=1×10-6 mol·L-1,溶液呈酸性,说明次氯酸电离程度大于次氯酸钠、碳酸氢钠水解能力,故有c(ClO-)>c(HCO3-),而HCO3-电离程度很小,则有c(HCO3-)>c(CO32-),B选项正确;氯的物质的量是碳的物质的量2倍,该溶液的物料守恒式有:c(ClO-)+c(HClO)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),C选项错误;该溶液的电荷守恒式为c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(ClO-)+2c(CO32-),D选项错误。
本题难度:一般
3、选择题 下列各组离子能大量共存的是?
[? ]
①漂白粉的水溶液中:Fe2+ 、Cl-、Ca2+ 、Na+ ?
②滴加石蕊呈红色的溶液:K+、NH4+、Cl-、S2-?
③能够与金属Cu常温下反应放出气体的溶液;Fe3+、Al3+、SO42-、K+ ?
④pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ ?
⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-?
A.②③?
B.①③?
C.③④?
D.①⑤
参考答案:C
本题解析:
本题难度:一般
4、选择题 溶液中含有NH4+、F-、HSO3-、K+等离子。向其中加入少量NaClO后,溶液中离子数目肯定增加的是
A.F-
B.ClO-
C.HSO3-
D.NH4+
参考答案:D
本题解析:NaClO有强氧化性,能氧化HSO3-,故HSO3-数减小。并水解呈碱性,抑制了铵根的水解,故铵根离子数增多。F-水解加强,数目减小,K+数不变。
本题难度:一般
5、填空题 (12分)①、同温、同压下,质量相等的SO2和CO2相比较,体积之比为 ,已知SO2和CO2均为酸性氧化物,写出CO2与足量NaOH溶液反应的离子方程式 。
②、某溶液中可能含有大量下列阴离子:OH-、SO42-、CO32-、Cl-。
(1)当溶液中存在大量H+时,则溶液中不可能有 。
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有 ,用离子方程式写出不可能存在的原因 , 。
参考答案:(本题共12分)①11:16(2分) CO2+2OH-=CO32-+H2O(2分)
②、(1)CO32-、OH-(2分)
(2)SO42-、CO32-(2分)
Ba2++ SO42- BaSO4↓ (2分) Ba2++ CO32-
BaSO4↓ (2分) Ba2++ CO32- BaCO3↓(2分)
BaCO3↓(2分)
本题解析:①二氧化硫的摩尔质量是64g/mol,二氧化碳的摩尔质量是44g/mol,所以同温同压下,质量相等的二者的体积比等于物质的量之比等于1/64:1/44=11:16;酸性氧化物与碱反应生成盐和水,二氧化碳与足量氢氧化钠反应生成碳酸钠和水,离子方程式为CO2+2OH-=CO32-+H2O;
②、(1)因为OH-、CO32-均与氢离子反应分别生成水、二氧化碳气体,所以当溶液中存在大量H+时,则溶液中不可能有CO32-、OH-;
(2)因为硫酸根离子、碳酸根离子均与钡离子反应生成沉淀,所以当溶液中有大量的Ba2+存在时,则溶液中不可能有SO42-、CO32-,反应的离子方程式是Ba2++ SO42- BaSO4↓、Ba2++ CO32-
BaSO4↓、Ba2++ CO32- BaCO3↓。
BaCO3↓。
考点:考查物质的量的有关计算,离子反应的判断与离子方程式的书写
本题难度:一般