微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是
[? ]
A.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=AlO2-+2H2O
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
C.用惰性电极电解熔融氯化钠:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用稀氢氧化钠吸收氯气:2OH-+Cl2==Cl-+ClO-+H2O
参考答案:D
本题解析:
本题难度:一般
2、填空题 日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
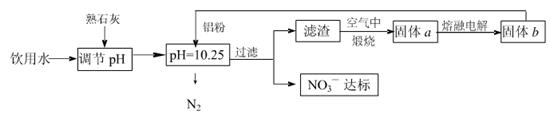
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成??的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为?。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为?
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为?。
(4)饮用水中的NO3-?主要来自于NH4+。已知在微生物作用下,NH4+?经过两步反应被氧化成NO3-?。两步反应的能量变化示意图如下:
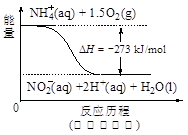 ?
?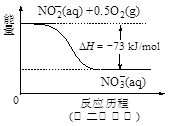
试写出1 mol NH4+?(aq)全部氧化成NO3-?(aq)的热化学方程式是?。
(5)固体a熔融电解时阴极反应式为?
参考答案:(1)铝(或Al)(2分)
(2)①10Al+6NO3—+18H2O=10Al(OH)3↓+3N2↑+6OH—(2分)
②4Al+ 3O2 2 Al2 O3? 2Al(OH)3
2 Al2 O3? 2Al(OH)3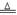 Al2 O3+3 H2O(各2分)
Al2 O3+3 H2O(各2分)
(3)5H2+2NO3—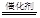 N2↑+4H2O+2OH— (2分)
N2↑+4H2O+2OH— (2分)
(或5H2+2NO3—+2H+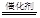 N2↑+6H2O)
N2↑+6H2O)
(4)NH4+?(aq)+2O2(g)=2H+(aq)+NO3-?(aq)+H2O(l)?△H=-346 kJ·mol-1(2分)
(5)Al3++3e-= Al(2分)
本题解析:(1)由于铝能和酸或碱都能反应,该方案在调节pH时,若pH过大或过小都会造成铝(或Al) 的利用率降低。(2)①铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3﹣反应的离子方程式为10Al+6NO3﹣+18H2O=10Al(OH)3+3N2↑+6OH﹣;②滤渣在空气中煅烧过程中涉及的相关反应方程式为4Al+ 3O2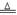 2 Al2 O3和2Al(OH)3
2 Al2 O3和2Al(OH)3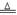 Al2 O3+3 H2O。(3)H2催化还原饮用水中NO3﹣,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3﹣
Al2 O3+3 H2O。(3)H2催化还原饮用水中NO3﹣,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3﹣ N2+4H2O+2OH﹣;(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2﹣ (aq)+H2O(l)△H=﹣2736 kJ?mol﹣1①,第二步热化学反应为NO2﹣ (aq)+0.5O2(g)=NO3﹣ (aq))△H=﹣73kJ?mol﹣1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3﹣ (aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3﹣ (aq)+H2O(l)△H=﹣346 kJ?mol﹣1。(5)固体a熔融电解时阴极是提电子的,反应式为Al3++3e-= Al。
N2+4H2O+2OH﹣;(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2﹣ (aq)+H2O(l)△H=﹣2736 kJ?mol﹣1①,第二步热化学反应为NO2﹣ (aq)+0.5O2(g)=NO3﹣ (aq))△H=﹣73kJ?mol﹣1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3﹣ (aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3﹣ (aq)+H2O(l)△H=﹣346 kJ?mol﹣1。(5)固体a熔融电解时阴极是提电子的,反应式为Al3++3e-= Al。
本题难度:一般
3、选择题 能正确解释下列反应原理的离子方程式是
A.用稀硝酸洗涤试管内壁的银镜:Ag+4H++3NO3-=Ag++NO↑+2H2O
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3↓+SO42-
参考答案:D
本题解析:A中电子的都是不守恒,B中小苏打是碳酸氢钠,应该拆成Na+和HCO3-,C中溶液显酸性,不可能生成OH-,所以正确的答案选D。
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.明矾溶液中滴加Ba(OH)2溶液至SO42–恰好完全沉淀:Al3++Ba2++ SO42–+3OH–=BaSO4↓+Al(OH)3↓
C.200 mL 2 mol·L–1的FeBr2溶液中通入11.2 L标准状况下的氯气:4 Fe2++6Br–+5Cl2=4Fe3++3Br2+ 10Cl–
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO–+2Fe(OH)3=2FeO42–+3Cl–+H2O+4H+
参考答案:C
本题解析:A、澄清石灰水少量时表现在离子方程式中,OH-应无剩余,而所给离子方程式中Ca2+与OH-的个数比为1:1,化学式中为1:2,所以方程式表达的是石灰水过量,与已知不符,错误;B、明矾的化学式中Al3+与SO42–的个数比为1:2,而该方程式中为1:1,说明SO42–没沉淀完全,错误;C、FeBr2的物质的量为0.4mol,氯气的物质的量为0.5mol,氯气先与Fe2+反应用掉0.2mol,余下的0.3mol与Br–反应,氯气不足,Br–只用掉0.6mol,所以Fe2+、Cl2、Br–的物质的量之比为0.4:0.5:0.6=4:5:6,正确;D、强碱性溶液中,反应后的溶液不会显酸性至大呈中性,错误,答案选C。
本题难度:简单
5、选择题 离子方程式CO32- + 2H+ ="=" H2O+ CO2↑中的CO32-代表的物质可以是?(?)
A.CaCO3
B.Na2CO3
C.BaCO3
D.NaHCO3
参考答案:B
本题解析:根据离子方程式可知,该碳酸盐一定是易溶、易电离的,所以选项B正确,A和C是难溶的,D是碳酸氢盐,答案选B。
点评:化学方程式改写成离子方程式的关键是牢记常见易溶和易电离的物质,因为只有同时满足易溶和易电离的物质,才能用离子符号表示,其余物质都是用化学式表示的。
本题难度:一般