微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
A.BaSO4的溶度积常数比BaCO3的小
B.S没有毒性,C有毒性
C.BaSO4的密度大
D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
参考答案:D
本题解析:BaSO4可作钡餐是因为硫酸钡不溶于酸。而BaCO3能与酸反应:BaCO3+2H+ Ba2++H2O+CO2↑,生成的Ba2+进入人体,会造成重金属盐中毒。所以D正确。
Ba2++H2O+CO2↑,生成的Ba2+进入人体,会造成重金属盐中毒。所以D正确。
本题难度:一般
2、选择题 下列实验操作不能达到其对应目的的是
序号
| 实验内容
| 实验目的
|
A.
| 向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液
| 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀
|
B.
| 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡
| 证明与苯环相连的甲基易被氧化
|
C.
| 向Na2SiO3溶液中通入CO2
| 证明碳酸的酸性比硅酸强
|
D.
| 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热
| 验证淀粉已水解
参考答案:D
本题解析:AgCl的Ksp大于Ag2S的Ksp,A正确;已烷不能被高锰酸钾溶液氧化,而甲苯之所以能被氧化,主要是苯环对甲基有影响,B正确;根据强弱生弱酸的道理,且有明显的现象,C正确;新制的氢氧化铜检验醛基,应在碱性条件下进行,而该水解后的溶液显酸性,D错;答案选D。
本题难度:一般
3、填空题 (本题共12分)磷是重要的非金属元素。
28.有关白磷(P4)的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.25℃时,HF的Ki =" 3.6×10"
参考答案:
本题解析:
本题难度:一般
4、填空题 (8分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4? B. H2O2? ? C. 氯水? ? D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH? B. NH3·H2O? C. CuO? D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。? ( 提示:lg5 =0.7)
参考答案:(8分)?(1) B(1分)? CD(2分)?(2)4(2分)? 3.3 (2分)?可行(1分)
本题解析:略
本题难度:一般
5、选择题 已知Ag2SO4的Ksp为2.0×l0-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图[饱和Ag2SO4溶液中c(Ag+)= 0.034 moI·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是?
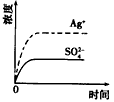
[? ]
A.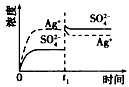
B.
C.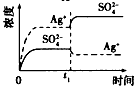
D.
参考答案:B
本题解析:
本题难度:一般
|