|
高考化学知识点归纳《难溶电解质的溶解平衡》高频试题预测(2017年最新版)(八)
2017-08-06 09:20:30
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CaSO4有很多用途,例如制豆腐就用到石膏(主要成分是CaSO4)。CaSO4微溶于水,溶于水的部分可以形成CaSO4饱和溶液,其饱和溶液中存在平衡:
CaSO4(s) Ca2+(aq)+SO42-(aq),分别采取下列措施,能使溶液中c(Ca2+)增大的是 Ca2+(aq)+SO42-(aq),分别采取下列措施,能使溶液中c(Ca2+)增大的是
A.降温
B.加入CaSO4
C.加入BaCl2
D.加水
|
参考答案:C
本题解析:
A、降温会使CaSO4的溶解平衡左移,溶液中c(Ca2+)减小,所以A不合题意;
B、加入CaSO4,因为原混合物为CaSO4的饱和溶液,所以不能再溶解更多的溶质,因而c(Ca2+)不变,故B不合题意;
C、加入BaCl2,则钡离子会与SO42-结合生成BaSO4沉淀,使CaSO4的溶解平衡右移,c(Ca2+)增大,故C符合题意;
D、加水,会促进CaSO4的溶解,但是c(Ca2+)减小,故D不合题意。
考点:考查沉淀的溶解平衡
点评:本题考查了沉淀的溶解平衡,难度不大。解题时应明确原混合物为CaSO4的饱和溶液。
本题难度:一般
2、选择题 向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是(?)
A.AgCl的溶解度增大
B.AgCl的溶解度、Ksp均不变
C.Ksp(AgCl)增大
D.AgCl的溶解度、Ksp均增大
参考答案:B
本题解析: AgCl的溶解度、Ksp均与温度有关,温度不变则不变。故选B。
点评:本题考查的是溶解平衡的应用和溶解度的相关知识,题目难度不大,注意对基础知识的学习、掌握及应用。
本题难度:一般
3、选择题 对于表达式PbI2(s)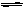 Pb2+(aq)+2I-(aq),下列描述正确的是? (? ) Pb2+(aq)+2I-(aq),下列描述正确的是? (? )
A.说明PbI2难电离
B.说明PbI2难溶解
C.这是电离方程式
D.这是沉淀溶解平衡表达式
参考答案:BD
本题解析:此题主要考查沉淀溶解平衡表达式的书写及其与电离平衡的区别。在书写沉淀溶解平衡表达式时,要特别注明沉淀的状态(s)及生成离子的状态(aq),这是它与电离方程式最大的不同这处,在判断时一定要看清楚。故A.C错误,B.D正确。
本题难度:一般
4、填空题 某火电厂的脱硫尾气通入饱和K2CO3溶液吸收池后,经分解池制得纯净的CO2,再在合成塔与H2反应生成甲醇。其工艺艺流程示意图如下:

(1)吸收池中饱和K2CO3溶液吸收CO2的离子方程式是 。
(2)流程示意图中循环使用的物质是 。
(3)300℃时,合成塔中的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号) CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)
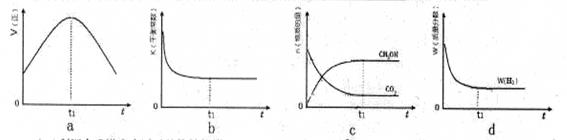
(4)利用合成塔中失活后的铬锌触媒可制得含有Cl- 和CrO42- 的溶液,其浓度均为0.01mol/L,向该溶液 中逐滴加入0.01mol/L的AgNO3溶液时,首先产生沉淀的阴离子是 (已知:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12)
(5)合成塔中失活的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:Zn(s) +2MnO2(s) +H2O(l) = Zn(OH)2(s) +Mn2O3(s) ,该电池正极的电极反应式是 。若用电池电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,电解过程中阴极的现象是 。
参考答案:(1)CO2+CO32-+H2O=2HCO3-
(2)K2CO3
(3)cd
(4)Cl-
(5)2MnO2+2e-+H2O=2OH-+Mn2O3 有无色气体和白色沉淀产生
本题解析:(1)K2CO3溶液的吸收CO2生成KHCO3,将K+删除写成离子方程式。
(2)KHCO3受热分解又得到K2CO3,这是循环物质;
(3)反应达到平衡状态又两个特征:一是v(正)= v(逆);二是各物质组分含量不变。a图像没有说明逆反应的速率,不能确定;b是反应得到平衡的常数K,与反应是否达到平衡无关,与温度有关,b不能判断平衡与否;c中的CH3OH和CO2的物质的量不变,即组分不变,说明得到平衡状态;d是H2的含量分数不变,也是组分恒定,说明得到平衡状态。
(4)0.01mol/L Cl-,开始沉淀时c(Ag+)=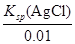 =1.56×10-8;0.01mol/L CrO42-,开始沉淀时c(Ag+)= =1.56×10-8;0.01mol/L CrO42-,开始沉淀时c(Ag+)= =3.0×10-5。故Cl-先沉淀。 =3.0×10-5。故Cl-先沉淀。
(5)氧化剂MnO2做正极材料,得电子,生成Mn2O3,注意环境,故生成OH-。电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,根据放电顺序,阳极Cl-放电,阴极水电离的H+放电,产生OH-,与Mg2+结合生成Mg(OH) 2白色沉淀。
考点:化学流程为载体,考查化学平衡图像、难溶物的Ksp计算及电化学反应原理。
本题难度:困难
5、选择题 Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12 ,已知,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1-、Br-、CrO42-
B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42-
D.Br-、CrO42-、C1-
|