红纸条褪色]
参考答案:A
本题解析:浓硝酸具有强氧化性和挥发性,挥发出的硝酸蒸汽接触淀粉碘化钾溶液时,将碘离子氧化为单质碘,碘遇淀粉显蓝色,A不正确;浓盐酸具有强挥发性,但酚酞试液遇酸不变色,B蒸汽;浓氨水易挥发出氨气,进入氯化铝溶液生成氢氧化铝白色沉淀,C蒸汽;饱和氯水会挥发出氯气,接触到湿润的红纸条,氯气和水反应生成具有漂泊性的次氯酸,红纸条褪色,D正确,答案选A。
点评:该题是2012年北京卷第10题,主要是结合元素化合物知识,重点考查学生对化学实验中的实验现象的观察和分析。
本题难度:简单
2、选择题 下列排列顺序正确的是( )
A.微粒半径:Na+>K+>Cl->S2-
B.稳定性:HBr>HCl>HF
C.酸性:HCl>H2SO4>H3PO4
D.金属性:Na>Mg>Al
参考答案:A、微粒电子层越多半径越大,所以微粒半径为K+、Cl-、S2-大于Na+,由核外电子排布相同的离子,核电荷数越多半径越小,则Cl->S2->K+,
所以微粒半径大小顺序为:Cl->S2->K+>Na+,故A错误;
B、同主族元素的原子从上到下,原子半径逐渐增大,得电子能力逐渐减弱,氢化物的稳定性逐渐减弱,所以稳定性:HBr<HCl<HF,故B错误;
C、同周期元素的原子从左到右,最高价氧化物对应水化物的酸性逐渐增强,同主族元素的原子从上到下,最高价氧化物对应水化物的酸性逐渐减弱,所以酸性:HClO4>H2SO4>H3PO4,故C错误;
D、同周期元素的原子从左到右,元素的金属性逐渐减弱,所以金属性:Na>Mg>Al,故D正确.
故选C.
本题解析:
本题难度:一般
3、填空题 分某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了一系列实验,实验结果记录如下:
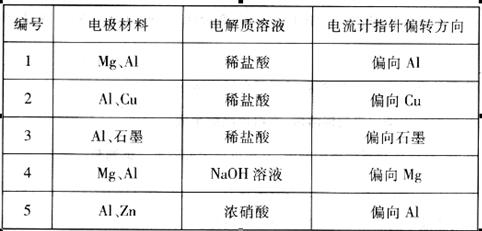
请根据上表中的实验记录回答下列问题:
(1)实验1、2中的Al所作的电极是否相同?____________________。
(2)在实验3中,Al作__________极,电极反应式为___________,电池总反应式为__________。
(3)实验4中的Al作正极还是负极?____________________,原因是____________________。
(4)解释实验5中电流计指针偏向Al的原因:__________________。
(5)根据实验结果,总结在原电池中金属铝作正极还是负极受到哪些因素的影响?____________________。
参考答案:(11分,除注明外,每空1分)(1)不相同
(2)负;Al-3e-===Al3+; 2Al+6H+===2Al3++3H2↑
(3)负极;因为铝能与氢氧化钠溶液反应而镁不能
(4)因为铝被浓硝酸钝化,锌与浓硝酸发生氧化还原反应(2分)
(5)电解质溶液、铝的性质、另一电极材料的活动性强弱 (3分,每答对一个得1分)
本题解析:活泼金属做负极,故实验1中的Al作正极、2中的Al作负极。
(2)在实验3中,Al作负极,电极反应式为Al-3e-===Al3+,电池总反应式为2Al+6H+===2Al3++3H2↑。
(3)实验4中电流表的指针偏向Mg,故Al作负极,因为铝能与氢氧化钠溶液反应而镁不能。
(4)解释实验5中电流计指针偏向Al的原因:因为铝被浓硝酸钝化,锌与浓硝酸发生氧化还原反应。
(5)根据实验结果,总结在原电池中金属铝作正极还是负极受到影响的因素有电解质溶液、铝的性质、另一电极材料的活动性强弱。
本题难度:一般
4、选择题 下列比较正确的是
[? ]
① 与冷水的反应速率:K>Na>Mg
② 热稳定性:HF>H2Se>H2S
③ 结合质子的能力:CH3CH2O->CH3COO->HCO3-
④ 离子半径:Cl->O2->Al3+
A.①④
B.②③
C.②④
D.①③
参考答案:A
本题解析:
本题难度:一般
5、选择题 某元素离子Am-的核内有n个中子,核外有x个电子。该元素原子的质量数为
A.x-n+m
B.x+m+n
C.m+n-x
D.x-m+n
参考答案:D
本题解析:试题分析:某元素离子Am-的核内有n个中子,核外有x个电子,则该元素的质子数是x-m。又因为质量数质量数=质子数+中子数,所以该微粒的质量数=x-m+n,答案选D。
考点:考查质量数的有关判断
点评:该题是基础性试题的考查,难度不大。该题的关键是明确质量数与中子数和质子数的数量关系,以及核外电子数与质子数的关系,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力。
本题难度:简单
|