微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 用如下装置可以完成一系列实验(图中夹持装置已略去).
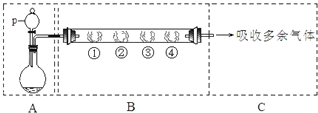
请回答下列问题:
Ⅰ.若装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④
所蘸试剂
石蕊试液
品红溶液
淀粉和碘水混合液
氢硫酸
现象
______
______
褪色
浅黄色
体现SO2的性质
水溶液显酸性
漂白性
______
氧化性
|
II.若装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.请回答下列问题:
(1)写出用浓硫酸和浓盐酸混合制取HCl气体时,有利于HCl气体逸出的原因(写出两点)______,______.
(2)反应开始后,观察到②处棉花变成棕黄色,则①处包有的某固体物质可能是______.
a.MnO2?b.KCl?c.KMnO4?d.Cu
写出②处发生反应的离子方程式______.
(3)在实验过程中,在③处能观察到______.
(4)反应较长时间后,②处的棕黄色褪去,产物之一为HIO3(强酸),写出该反应的离子方程式:______.
参考答案:Ⅰ.①二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以显酸性,石蕊试液遇酸显红色.
②二氧化硫有漂白性,能使品红溶液褪色.
③二氧化硫有还原性,碘单质有氧化性,二氧化硫和碘能发生氧化还原反应,所以淀粉和碘水混合液会褪色.
故答案为:变红;褪色;还原性.
II.(1)浓硫酸有吸水性,吸收浓盐酸中的水分而促进浓盐酸的挥发;浓硫酸稀释时放出热量,也促进浓盐酸的挥发.
故答案为:浓硫酸具有吸水性,稀释时放热.?
(2)反应开始后,观察到②处棉花变成棕黄色,说明有碘单质生成,所以①有氯气生成.
a.MnO2和浓盐酸反应必须在加热条件下才能反应,故错误.
b.KCl和氯化氢不反应,故错误.
c.KMnO4?有强氧化性,氯化氢有还原性,所以氯化氢和高锰酸钾能发生氧化还原反应生成氯气,氯气置换碘单质,故正确.
d.Cu和氯化氢不反应,故错误.
故选C.
氯气有强氧化性,能和碘离子发生置换反应生成碘单质,离子反应方程式为:Cl2+2I-=I2+2Cl-.
故答案为:C;Cl2+2I-=I2+2Cl-.
(3)氯气和水反应生成盐酸和次氯酸,石蕊试液遇酸变红色,次氯酸有漂白性,所以氯气通过蘸有石蕊溶液先变红后褪色.
故答案为:先变红后褪色.
(4)氯气有强氧化性,碘既有氧化性又有还原性,所以氯气和碘反应时,碘作还原剂,结合题意知,碘和氯气、水反应生成盐酸和碘酸,离子方程式为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
本题解析:
本题难度:一般
2、填空题 CO、NO与SO2等物质是大气污染物。
(1)SO2不仅本身污染大气,而且它在大气中经尘粒催化能与水、氧气作用形成危害更大的酸雨,反应的化学方程式是:①___________②___________。
(2)CO、NO是汽车尾气的主要成分之一。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出一氧化碳与一氧化氮反应的化学方程式:___________。
参考答案:(1)①2SO2+O2===2SO3;②SO3+H2O=H2SO4;
(2)2CO+2NO 2CO2+N2
2CO2+N2
本题解析:
本题难度:一般
3、实验题 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=________________.
(2)反应Cl2+Na2SO3+2NaOH==2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
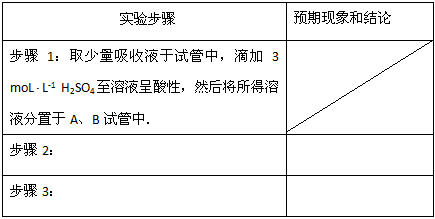
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO-;假设3:_____________.
② 设计实验方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂:3moL/LH2SO4、1moL/LNaOH、0.01mol/LKMnO4、淀粉-KI溶液、紫色石蕊试液.
参考答案:(1)Na2SO3+H2O
(2)Na2SO3
(3)①SO32-、ClO-都存在②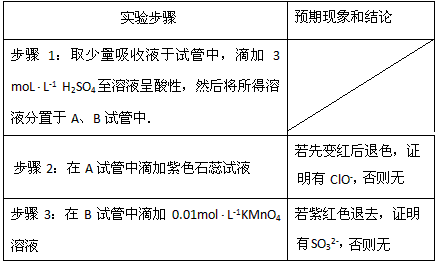
本题解析:
本题难度:困难
4、选择题 下述实验不能达到预期目的是( )
| 编号 | 实验内容 | 实验目的
A
将铜片分别与浓、稀硝酸反应
探究浓、稀硝酸氧化性的相对强弱
B
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置
比较氯与溴的氧化性强弱
C
将SO2通入酸性KMnO4溶液中
证明SO2具有漂白性
D
向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀.再加入少许浓硫酸,迅速搅拌.
探究浓硫酸的脱水性
|
A.A
B.B
C.C
D.D
参考答案:A.硝酸的浓度越大,反应快,氧化性强,则可利用Cu与浓、稀硝酸反应来确定其氧化性的强弱,故A正确;
B.氯气与NaBr发生置换反应生成Br2,由氧化还原反应可知氧化性氯气大于溴,则可比较,故B正确;
C.因SO2具有还原性,能被KMnO4氧化,则将SO2通入酸性KMnO4溶液中,溶液褪色,可说明SO2具有还原性,故C错误;
D.蔗糖中含有C、H、O元素,浓硫酸具有脱水性,使蔗糖炭化,所以向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀.再加入少许浓硫酸可说明浓硫酸具有脱水性,故D正确;
故选C.
本题解析:
本题难度:简单
5、选择题 二氧化硫和氯气均有一定的漂白作用,前者是因为它与水生成的亚硫酸可与有色有机物加成得到无色物质,其过程可逆:后者是因为它与水作用生成的次氯酸具强氧化性氧化有色物,其过程不可逆。若将相同条件下等体积的这两种气体混合后通入到溶有品红和硝酸钡的水中,能观察到的现象是
[? ]
A.溶液很快褪色
B.溶液不褪色
C.出现白色沉淀
D.无明显现象
参考答案:BC
本题解析:
本题难度:一般