微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 含有少量二价锰盐的溶液,在浓HNO3中与PbO2混合煮沸,溶液呈现紫红色,PbO2转化为Pb(NO3)2,反应中无气体生成,该反应的离子方程式______,每消耗1mol氧化剂,被氧化的还原剂的物质的量为______mol.
参考答案:.根据题意知,在反应中PbO2得电子转化为为Pb(NO3)2,所以二氧化铅是氧化剂,则二价锰失电子作还原剂,溶液呈红色,说明二价锰离子被氧化生成高锰酸根离子,所以反应的离子方程式为 2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O;
设每消耗1mol氧化剂,被氧化的还原剂的物质的量是x.
2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O
2mol? 5mol
x? 1mol
x=0.4mol.
故答案为:2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O;0.4mol.
本题解析:
本题难度:简单
2、选择题 下列反应中,属于氧化还原反应的是( )
A.SO2+2KOH=K2SO3+H2O
B.CaCO3
+CO2↑
C.Na2CO3+CaCl2═CaCO3↓+2NaCl
D.Fe+2FeCl3=3FeCl2
参考答案:A、该反应中各元素的化合价都不变,所以不是氧化还原反应,故A错误;
B、该反应中各元素的化合价都不变,所以不是氧化还原反应,但属于分解反应,故B错误;
C、该反应中各元素的化合价都不变,所以不是氧化还原反应,但属于复分解反应,故C错误;
D、该反应中,铁元素化合价既有升高的也有降低的,属于氧化还原反应,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 关于分类的说法正确的是( )
①物质分为电解质与非电解质?②物质分为单质与化合物③化学反应分为:氧化还原反应与非氧化还原反应.
A.①
B.②③
C.③
D.①③
参考答案:C
本题解析:
本题难度:简单
4、选择题 以下反应常用于合成电子、陶瓷工业常用的氮化铝(AlN)Al2O3+N2+3C
2AlN+3CO.下列有关说法正确的是( )
A.氮化铝中氮元素化合价为-3
B.该反应中,每断裂NA个N≡N,电子转移为3mol
C.该反应中,Al2O3是氧化剂,N2和C是还原剂
D.该反应利用了CO的还原性
参考答案:A、N元素的非金属性强,铝元素显+3价,根据正负化合价的代数和为0,AlN中N为-3价,故A正确;
B、依据反应Al2O3+N2+3C?高温?.?2AlN+3CO,氮元素化合价降低,碳元素化合价升高,每断裂NA个N≡N,电子转移为6mol,故B错误;
C、Al2O3+N2+3C?高温?.?2AlN+3CO中,碳元素的化合价由0升高到+2价,氮元素的化合价由0降低为-3价,在氮化铝的合成反应中,N2是氧化剂,C是还原剂,故C错误;
D、氮元素的化合价由0降低为-3价,碳元素化合价升高,碳是反应的还原剂,故D错误;
故选A.
本题解析:
本题难度:简单
5、简答题 现有一未配平的氧化还原反应:KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X,请回答下列问题
(1)该反应的还原剂是______
(2)已知0.2molKClO3在反应中得到1mol电子生成X,则X的化学式是______
(3)根据上述反应可推知______.
A.氧化性:KClO3>H3PO4 B.氧化性:H3PO4>KClO3
C.还原性:PH3>XD.还原性:X>PH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:______.
参考答案:(1)该反应中P元素的化合价由-3价升高为+5价,则PH3为还原剂,故答案为:PH3;
(2)设还原产物X中Cl元素的化合价为x,由电子转移可知,0.2mol×(5-x)=1mol,解得x=0,则还原产物X为Cl2,故答案为:Cl2;
(3)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,则氧化性为KClO3>H3PO4,还原性为PH3>X,
故答案为:AC;
(4)氧化剂为KClO3,还原剂为PH3,该反应中转移40e-,电子转移的方向和数目为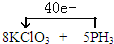 ,故答案为:
,故答案为: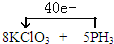 .
.
本题解析:
本题难度:一般