微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是
[? ]
A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2
参考答案:D
本题解析:
本题难度:一般
2、选择题 某国曾发生一起重大交通事故:一辆载有硝酸铵的列车与另一辆列车相撞导致电线短路继而引发剧烈爆炸,造成重大人员伤亡.硝酸铵受撞击或高温发生爆炸的反应为:aNH4NO3→bO2↑+cX↑+dH2O,若NH4NO3与O2的物质的量之比为2:1,则X的化学式为( )
A.N2
B.N2O
C.NO
D.NO2
参考答案:NH4NO3与O2的物质的量之比为2:1,
设有2molNH4NO3参加反应,生成1molO2,
根据H守恒可知应生成4molH2O,
根据O元素守恒可知生成物X不含O元素,应为N2,
故选A.
本题解析:
本题难度:一般
3、选择题 火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(C u2S)中提取铜,发生如下反应:
①2CuFeS2+4O2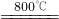 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
②2Cu2S+3O2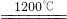 2Cu2O+2SO2
2Cu2O+2SO2
③2Cu2O+Cu2S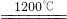 6Cu+SO2↑
6Cu+SO2↑
下列说法正确的是
A.反应②、③中,Cu2S都只做还原剂
B.1mol?CuFeS2生成1molCu,理论上消耗2.5mol?O2
C.1mol?Cu2S和O2反应生成2molCu转移的电子数为4mol
D.反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2
参考答案:B
本题解析:分析:A.②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价;
D.反应①中,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高.
解答:A.②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,故A错误;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol?CuFeS2生成1molCu,理论上消耗2.5molO2,故B正确;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故C错误;
D.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价,2molCuFeS2反应转移电子为24mol,故D错误;
故选B.
点评:本题考查氧化还原反应及计算,明确反应中的元素的化合价变化是解答本题的关键,注意电子守恒、原子守恒的应用,选项D为易错点,题目难度较大.
本题难度:困难
4、选择题 一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4?(g)+4NO2?(g)=4NO?(g)+CO2?(g)+2H2O?(g);△H=-574kJ?mol-1
②CH4?(g)+4NO?(g)=2N2?(g)+CO2?(g)+2H2O?(g);△H=-1160kJ?mol-1.
下列选项正确的是( )
A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);△H=-867kJ?mol-1
B.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为173.4kJ
C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2mol
D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为1.6mol
参考答案:A、利用盖斯定律,将题中反应①+②2可得:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,气态水变为液态水是要放热,则
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);△H<-867kJ?mol-1,故A错误;
B、若0.2molCH4还原NO2至N2,在上述条件下放出的热量为0.2mol×867kJ?mol-1=173.4kJ,故B正确;
C、由于CH4和NOx物质的量不确定,不一定为1mol,则转移的电子的物质的量不确定,故C错误;
D、若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为2.24L22.4L/moL×[+4-(-4)]=0.8mol,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知:还原性I-> Fe2+> Br->Cl-)
[? ]
A.7:1
B.7:2
C.7:3
D.7:4
参考答案:C
本题解析:
本题难度:一般