微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,将a1 mL,b1 mol/L的CH3COOH溶液加入到a2 mL,b2 mol/L的NaOH溶液中,下列结论中不正确的是
A.如果a1b1=a2b2,则混合溶液的pH>7
B.如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH<7,则bl>b2
参考答案:C
本题解析:A项a1b1=a2b2,醋酸与NaOH溶液完全反应生成CH3COONa,CH3COO-水解显碱性pH>7,正确。B项溶液呈中性c(OH-)=c(H+), c(CH3COO-)=c(Na+),正确。
C项当a1=a2,b1=b2时,醋酸与NaOH溶液完全反应,所得溶液为强碱弱酸盐,CH3COO-水解,c(CH3COO-)<c(Na+),错误。D项混合溶液的pH<7,CH3COOH过量,正确。
本题难度:困难
2、选择题 0.1 mol·L-1 Na2CO3和0.1 mol·L-1 NaHCO3溶液的pH,前后两个量的大小关系为
A.大于
B.等于
C.小于
D.不能肯定
参考答案:A
本题解析:同浓度的Na2CO3与NaHCO3溶液中,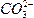 的水解程度比
的水解程度比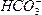 大得多,Na2CO3溶液的碱性强,故前者的pH大。
大得多,Na2CO3溶液的碱性强,故前者的pH大。
本题难度:一般
3、选择题 下列叙述正确的是
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列反应中,反应条件与反应物用量改变时不影响其反应产物的是
A.Na+O2
B.C+O2
C.CO2+Ca(OH)2
D.Na2O2+CO2
参考答案:D
本题解析:A中随反应条件的不同可产生Na2O或Na2O2;B中随氧气的用量的不同可产生CO或CO2;C中随CO2的量的不同可产生碳酸钙或碳酸氢钙.
本题难度:简单
5、选择题 下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
参考答案:C
本题解析:A不正确,不符合质子守恒,应该是c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3).B不正确,不符合电荷守恒,应该是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)。酸越弱,相应的钠盐越容易水解,醋酸的酸性强于碳酸的,所以碳酸钠的碱性强于醋酸钠的,C正确。D不正确,根据电荷守恒可知,c(CH3COO-)=c(Na+)>c(OH-)=c(H+),答案选C。
本题难度:一般