|
高考化学知识点总结《化学基本概念》高频试题特训(2017年最新版)(八)
2017-08-06 09:58:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于氧化还原反应10AgF+5C12+5H2O==9口+AgClO3+10HF+O2,下列说法不正确的是
A.每生成1 mol O2,该反应转移电子的物质的量是4NA
B.该反应中Cl2既是氧化剂,又是还原剂
C.口中的物质是AgCl
D.该反应消耗的水有2/5被氧化
|
参考答案:A
本题解析: 根据反应方程式可知:元素化合价升高的元素有O、Cl,元素化合价降低的元素是Cl。A.每生成1 mol O2,根据电子守恒可知:该反应转移电子的物质的量是9NA,错误;B.由于在反应中Cl2中的Cl元素的化合价既升高也降低,所以在该反应中Cl2既是氧化剂,又是还原剂,正确;C.结合元素守恒和电子守恒可知口中的物质是AgCl。正确;D.在该反应消耗的水有2/5化合价升高,失去电子而被氧化,正确。
考点:考查氧化还原反应中的电子转移、物质确定和物质的作用的知识。
本题难度:一般
2、选择题 常温下,在10 L容器中通入A mol氢气和B mol氧气(A、B均为小于或等于4的正整数),点燃后充分反应,恢复到常温,容器内的气体(水蒸气的体积忽略不计)密度(g/L)最大值可能是
A.6.4
B.9. 6
C.11.2
D.12.8
参考答案:C
本题解析:因为密度=气体质量/气体体积,而气体体积恒为10 L,所以所剩的氧气(摩尔质量比氢气大)越多,则最后气体的密度也越大,因此,反应前氧气应尽可能多;氢气则尽可能少,据题意可知,此时氧气的物质的量应为4 mol,氢气的物质的量应为1 mol,则有:
2H2? +? O2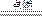 2H2O 2H2O
2? 1
1 mol? 0.5 mol
故,反应后剩余氧气的物质的量为
4 mol-0.5 mol="3.5" mol
此时容器内的气体密度为: ="11.2" g·L-1,应选C。 ="11.2" g·L-1,应选C。
本题难度:困难
3、选择题 下列物质能发生银镜反应的是
A.酒精
B.葡萄糖
C.淀粉
D.纤维素
参考答案:B
本题解析:试题分析:能发生银镜反应的物质含有醛基。酒精中的官能团是羟基,不能发生银镜反应,淀粉和纤维素都是非还原性糖,都不能发生银镜反应。
考点:官能团的性质
点评:掌握官能团的性质。
本题难度:一般
4、选择题 生产上常在苹果汁中加维生素C以防其变色 这是利用维C的( )性质
A.氧化性 B.还原性 C酸性 D.挥发性
参考答案:B
本题解析:略
本题难度:简单
5、实验题 (18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
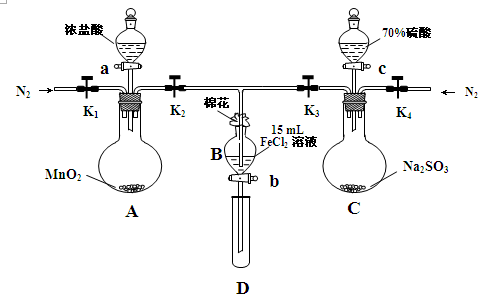
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子
| 过程Ⅵ B溶液中含有的离子
| 甲
| 有Fe3+无Fe2+
| 有SO42-
| 乙
| 既有Fe3+又有Fe2+
| 有SO42-
| 丙
| 有Fe3+无Fe2+
| 有Fe2+
|
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液
颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色) FeSO3(s)(墨绿色)
提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
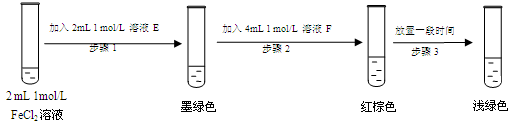
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
参考答案:(1)排除空气(1分) (2)NaOH溶液 (3)MnO2 + 4HCl(浓) △MnCl2+Cl2↑+ 2H2O
(4)70%H2SO4中c(H+)大 (5)2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42-+4H+ (6)乙、丙
(7)① Na2SO3溶液 、FeCl3溶液
②Fe3+ 消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq) FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。(3分) FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。(3分)
本题解析:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气。
(2)氯气、二氧化硫有毒,棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气。
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为MnO2 + 4HCl(浓) △MnCl2+Cl2↑+ 2H2O。
(4)因氢离子浓度越大,反应速率越快,则70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大,所以反应速率快。
(5)铁离子能把二氧化硫氧化生成硫酸,反应的离子方程式为2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42-+4H+。
(6)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,故答案为:乙、丙。
(7)①E与氯化亚铁溶液反应产生墨绿色,说明反应中有亚硫酸亚铁生成,因此E应该是Na2SO3溶液。根据FeSO3(墨绿色)与FeCl3(黄色)的混合后溶液显红棕色可知,F应该是FeCl3溶液。
②铁离子具有氧化性,因此Fe3+ 消耗 SO32-,导致c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq) FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。 FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
考点:考查性质实验方案的设计及氧化还原反应和平衡移动原理应用
本题难度:困难
|  FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)