微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是?
[? ]
A、因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 ?
B、25℃、101?kPa时,1?mol?S和2?mol?S的燃烧热不相等 ?
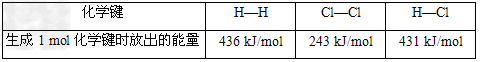
C、通常人们把拆开1?mol某化学键所吸收的能量看成该化学键的键能。如上图,则
 ?
?
D、将1?mol一氧化碳和1?mol水蒸气放入一固定容积的密闭容器中,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6?mol二氧化碳,再加入2?mol水蒸气,在相同条件下达到新的平衡时二氧化碳的体积分数减小
CO2(g)+H2(g),在一定温度下,反应达到平衡后,得到0.6?mol二氧化碳,再加入2?mol水蒸气,在相同条件下达到新的平衡时二氧化碳的体积分数减小
参考答案:D
本题解析:
本题难度:一般
2、选择题 已知工业上真空炼铷的原理如下: ,对于此反应的进行能给予正确解释的是
,对于此反应的进行能给予正确解释的是
[? ]
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. 的热稳定性不如RbCl强
的热稳定性不如RbCl强
D.铷的单质状态较化合态更稳定
参考答案:B
本题解析:
本题难度:一般
3、填空题 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应为:N2(g)+3H2(g) 2NH3(g)
2NH3(g) 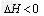 。
。
①下列措施可以提高H2的转化率的是(填选项序号)__________。
a.选择适当的催化剂?b.增大压强 ?c.及时分离生成的? d.升高温度
②一定温度下,在密闭容器中充入1mol N2和3mol H2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的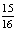 ,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。
,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g)?
2NO2(g)?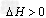 。该反应的反应速率(
。该反应的反应速率(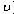 )随时间(t)变化的关系如图所示。若?时刻只改变一个条件,下列说法正确的是(填选项序号)_________。
)随时间(t)变化的关系如图所示。若?时刻只改变一个条件,下列说法正确的是(填选项序号)_________。
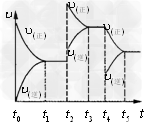
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 ?
b.在t2时,采取的措施可以是升高温度?
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 ?
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:
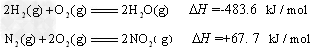
则H2还原NO2生成水蒸气反应的热化学方程式是_________________。
②碱液吸收法:用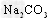 溶液吸收NO2生成CO2。若
溶液吸收NO2生成CO2。若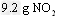 和
和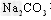 溶液完全反应时转移电子0.1?mol,则反应的离子方程式是______________________。
溶液完全反应时转移电子0.1?mol,则反应的离子方程式是______________________。
参考答案:(1)①bc;②12.5%?;>
(2)ab
(3)①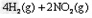

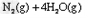 ?
?  =
=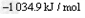 ;②
;②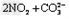

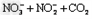
本题解析:
本题难度:一般
4、选择题 用CO合成甲醇的化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(b)>υ(c)
C.平衡常数:K(b)>K(d)
D.CH3OH的体积分数?(a)>?(b)>?(c)
