微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 石棉是一类具有压伸强度大、柔韧性强、耐热、耐高温、耐酸碱腐蚀,而且价格低廉的硅酸盐.石棉有毒,能使人患肺癌.有一种叫做矿青石棉,它的化学式为Na2Fe5Si8O22(OH)2.
(1)该石棉中与5个铁原子形成氧化物的氧原子数目是______个;
(2)式中铁元素的“平均化合价(或氧化数)”可视为______;
(3)将该石棉化的化学式改写为氧化物的形式:______;
(4)这种石棉属于传统的无机非金属材料,下列哪些不属于传统的无机非金属材料
A.光导纤维?B.水泥?C.耐高温的金属钛?D.氧化铝陶瓷?E.混凝土
(5)该石棉与酸或碱反应可以看作是各氧化物分别与酸或碱反应,若将这种石棉溶于足量的稀硝酸中,充分反应后过滤,滤渣主要是______,滤液中的盐类物质主要有______(填化学式).
参考答案:(1)除去钠、硅、氢的氧化物Na2O、8SiO2、H2O之外,根据氧原子守恒,剩余的氧为6个全部和铁原子结合,故答案为:6;
(2)钠元素的化合价为+1价,氧元素化合价为-2价,硅元素化合价为+4价氢元素化合价为+1价,根据化合价规则,设铁的化合价为x,则1×2+5x+4×8-2×22-1×2=0,得x=2.4或125,确定铁元素的化合价为2.4或125,故答案为:2.4或125;
(3)根据硅酸盐的氧化物表示方法的原则和写法,结合原子个数守恒和化合价不变的思想,得Na2O?3FeO?Fe2O3?8SiO2?H2O,故答案为:Na2O?3FeO?Fe2O3?8SiO2?H2O;
(4)水泥、陶瓷、二氧化硅均是传统的无机非金属材料,故答案为:CD;
(5)二氧化硅和硝酸不反应,氧化钠、氧化铁、氧化亚铁能溶于强酸得到对应的盐,这种石棉溶于足量的稀硝酸中,所得滤渣主要是二氧化硅,滤液是氧化钠、氧化铁溶于强酸得到对应的盐NaNO3、Fe(NO3)3,氧化亚铁溶于硝酸并被氧化为硝酸铁,故答案为:SiO2;NaNO3、Fe(NO3)3.
本题解析:
本题难度:一般
2、选择题 二十一世纪被称为海洋世纪,许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A.氯、溴、碘
B.钠、镁、铝
C.烧碱、氢气
D.食盐、淡水
参考答案:D
本题解析:考查海水的综合利用。选项ABC中都含有单质,需要通过化学变化才能得到,D中都是通过物理变化得到的,答案选D。
本题难度:简单
3、选择题 化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.无论是风力发电还是潮汐发电,都是将化学能转化为电能
B.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
C.推广燃煤脱硫技术,可以防治SO2污染
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
参考答案:C
本题解析:A选项是不是化学能转化为电能,而是机械能转化为电能,B选项,制造光缆的主要材料是二氧化硅D选项太绝对了,适量的食品添加剂对人体没有危害。C选项正确,初步开采的煤中含有硫,燃烧可以和氧气反应生成二氧化硫污染空气,脱硫后可以防治二氧化硫污染
本题难度:一般
4、选择题 关于工业生产的下列说法正确的是( )
A.工业上铁的冶炼是在沸腾炉中进行
B.从海水中提取镁时,需要将石灰石加入海水沉淀池中,得到氢氧化镁沉淀
C.以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”
D.在生产玻璃、水泥和炼铁时,都用到的原料是纯碱
参考答案:C
本题解析:
本题难度:一般
5、填空题 海洋是个巨大的资源宝库,海水资源的利用具有非常广阔的发展前景。海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下所示:
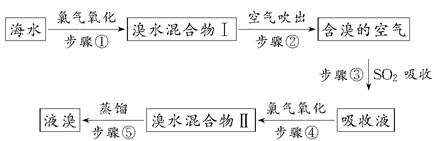
(1)步骤①反应的廊子方程式为_______________________________。
(2)步骤③反应的化学方程式为_________________________________。
(3)Br的原子序数是________,在周期表中位于第________周期、________族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________。
(5)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏,得出液溴?
参考答案:(1)2Br-+Cl2=Br2+2Cl- (2)SO2+Br2+2H2O=2HBr+H2SO4 (3)35 四 ⅦA (4)温度过高,大量水蒸气随溴蒸气排出,溴蒸气中水增加,温度过低,溴不能完全蒸出,回收率降低 (5)“溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高;经过“空气吹出、SO2吸收、氯气氧化”等步骤实际上是将溴水浓缩了
本题解析:(1)Cl的非金属性大于Br,海水中含有的Br-被氯气置换,Cl2+2Br-=Br2+2Cl-。
(2)空气中的Br2与SO2反应,得到含高浓度Br-的溶液,SO2+2H2O+Br2=2HBr+H2SO4。
(3)溴为第四周期,ⅦA族元素;根据各周期元素的个数,计算第四周期稀有气体元素的原子序数,由此推出Br的原子序数=2+8+8+18-1=35。
(4)根据蒸馏分离原理进行回答。水的沸点为100℃,温度过高水蒸发量增大,温度过低,溴的挥发量减少,不能完全蒸出,回收率降低。
(5)海水中Br-的含量很低,因此“溴水混合物Ⅰ”中溴的含量很低,直接蒸馏,处理液体的量很大,能耗高,成本增加;经过一系列处理后的“溴水混合物Ⅱ”中Br2的浓度增大,蒸馏时,所需处理的液体量大大减少,能耗降低,成本降低。
本题难度:一般