微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于相同质量的SO2和SO3的说法正确的是?(?)
A.硫元素的质量之比为1:1
B.分子数之比为1:1
C.原子总数之比为15:16
D.质量之比为5:4
参考答案:C
本题解析:略
本题难度:简单
2、实验题 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
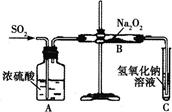
请回答下列问题:
(1)第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是________________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3__________。
(3) 设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:

上述方案是否合理?________ (若不合理,请说明理由;若合理,以下不用回答)
①?
②?
参考答案:(7分)(1)2Na2O2 + 2SO2 = 2 Na2SO3 +O2? (2分)
(2)取反应生成的白色固体少许,加一定量的稀硫酸,如果产生无色有刺激气味的气体(且能使品红溶液褪色),则说明生成了Na2SO3 (2分)
(3)不合理?(1分)
①稀硝酸能将亚硫酸钡氧化为硫酸钡而不溶解?(1分)
②如果反应后的固体中还残留Na2O2,它溶于水后也能将SO32-氧化成SO42-?(1分)
本题解析:略
本题难度:一般
3、实验题 (11分)某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。
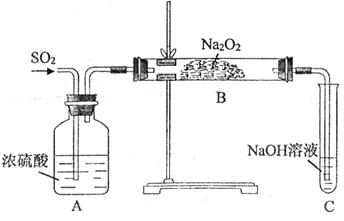
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据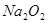 和
和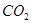 的反应,用类比的方法推理
的反应,用类比的方法推理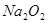 与
与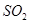 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据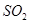 的强还原性和
的强还原性和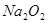 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有 。为检验生成物中是否存在
。为检验生成物中是否存在 ,他们设计了如下实验方案:
,他们设计了如下实验方案:
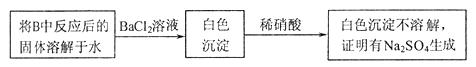
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向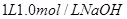 溶液中缓慢通入
溶液中缓慢通入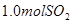 气体,请分析通入
气体,请分析通入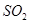 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。
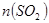 的范围 的范围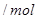
| 溶液中溶质的化学式
|
(0,0.5)
| __________
|
__________
| 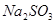 、 、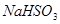
|
请在下图中画出溶液中溶质的总质量随缓慢通入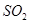 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)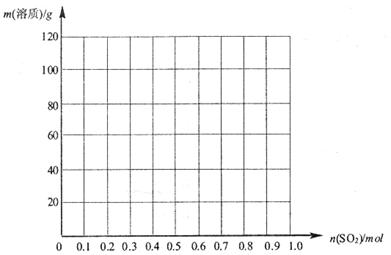
参考答案:(1)干燥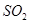 (1分)
(1分)
(2)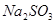 (1分);不合理(1分),
(1分);不合理(1分),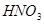 可将
可将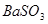 氧化为
氧化为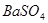 或过量的
或过量的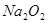 可将
可将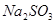 氧化为
氧化为 (1分)
(1分)
(3) 和
和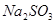 (2分);(0.5,1.0)(2分)
(2分);(0.5,1.0)(2分)
本题解析:(1)由于SO2中含有水蒸气,而水也能和过氧化钠反应,所以浓硫酸的作用是干燥SO2。
(2)过氧化钠和CO2的生成物是碳酸钠和氧气,据此类推SO2和过氧化钠反应的固体生成物应该是Na2SO3。由于稀硝酸具有氧化性,能把BaSO3氧化生成BaSO4,其次过量的过氧化钠也能把Na2SO3氧化生成Na2SO4,因此是不合理的。
(3)氢氧化钠和SO2反应的方程式为2NaOH+SO2=Na2SO3+H2O、NaOH+SO2=NaHSO3。因此根据方程式可知,如果SO2的物质的量小于0.5mol,则溶液中的溶质就是NaOH和Na2SO3;如果SO2恰好是0.5mol,则溶质只有Na2SO3;如果SO2的物质的量大于0.5mol,而小于1.0mol,则溶质是Na2SO3和NaHSO3;如果SO2恰好是1mol,则溶质只有NaHSO3。由于氢氧化钠和SO2都是1mol,所以氢氧化钠是40g,最多生成亚硫酸钠是63g,亚磷酸氢钠是104g,图像见答案。
本题难度:一般
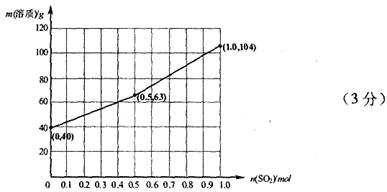
4、填空题 下列溶液中可能含有 、
、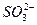 、S2-、Cl-、Br-、I-、
、S2-、Cl-、Br-、I-、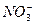 、Na+、Mg2+等离子。
、Na+、Mg2+等离子。
(1)若滴入溴水后,溶液由无色变成棕黄色,并出现浑浊,则溶液中一定含有__________。
(2)若加入硝酸钡溶液,有白色沉淀生成,再加入盐酸,沉淀少部分溶解,原溶液中一定含有__________。
(3)若加入氯化钡溶液及盐酸的混合溶液无沉淀生成。若先加氯水,然后再加入氯化钡溶液和盐酸,有白色沉淀生成,则原溶液中一定含有__________。
(4)若加入氢氧化钡无沉淀生成,加入硝酸银溶液也无沉淀生成,则原溶液中阴、阳离子只可能是__________。
参考答案:(1)Br-、S2-、Na+?(2) 、
、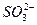 、Na+
、Na+
(3)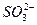 、Na+?(4)Na+、
、Na+?(4)Na+、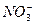
本题解析:离子存在的情况决定了所加试剂及产生的现象。
(1)滴入溴水后溶液由无色变为棕黄色并出现浑浊,溶液中一定含有I-,I-被Br2氧化为单质:2I-+Br2====I2+2Br-,故溶液变为棕黄色。
出现浑浊是由于S2-被氧化为单质S出现沉淀:S2-+Br2====2Br-+S↓,所以也一定含有S2-。
因为有阴离子就必须有与之相应的阳离子,故必有Na+。
(2)加入硝酸钡有白色沉淀生成,现加入盐酸,沉淀少部分溶解,则溶液中必含有 ,生成的BaSO4不溶于水,不溶于酸;也一定含有
,生成的BaSO4不溶于水,不溶于酸;也一定含有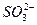 ,生成BaSO3沉淀,不溶于水,可溶于酸。
,生成BaSO3沉淀,不溶于水,可溶于酸。
同样该溶液中必含阳离子。由于Na2SO4、Na2SO3、MgSO4可溶于水,而MgSO3微溶于水,可能形成沉淀,Mg2+与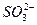 不能大量共存,故此溶液中必含Na+。
不能大量共存,故此溶液中必含Na+。
(3)若在溶液中加入氯化钡和盐酸的混合溶液,无沉淀生成。先加入氯水,然后再加入氯化钡溶液及盐酸,有白色沉淀产生。该溶液中必含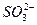
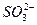
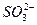 ,因为在酸性条件下不可能生成BaSO3的沉淀,而加入氯水后,
,因为在酸性条件下不可能生成BaSO3的沉淀,而加入氯水后,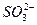 被氧化为
被氧化为 :
:
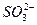 +Cl2+H2O====
+Cl2+H2O==== +2H++2Cl-
+2H++2Cl-
故再加入氯化钡溶液及盐酸将产生不溶于酸的白色沉淀BaSO4。该溶液中的阳离子应为Na+,因为Mg2+与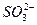
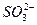 不能大量共存。
不能大量共存。
(4)若加入Ba(OH)2溶液无沉淀,则溶液中无 、
、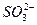 、Mg2+,若加入AgNO3无沉淀,则溶液中无Cl-、Br-、I-、
、Mg2+,若加入AgNO3无沉淀,则溶液中无Cl-、Br-、I-、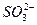 、
、 等离子,所以溶液只可能存在Na+和
等离子,所以溶液只可能存在Na+和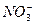 。
。
本题难度:简单
5、选择题 有一白色粉末X,对其进行检验如下:取少量该白色粉末X加入适量硫酸将其溶解,将产生的气体通入一定量苛性钠溶液中得溶液Y,取少量溶液Y,加入BaCl2溶液产生白色沉淀,加入盐酸沉淀溶解;另取少量Y溶液,加入溴水后,向所得溶液中加入BaCl2溶液产生白色沉淀,加入盐酸沉淀不溶解;蒸发剩余的溶液Y得白色粉末。则X的化学式为(?)
A.Na2SO4
B.Na3PO4
C.(NH4)2SO4
D.(NH4)2SO3
参考答案:D
本题解析:从四个选项中发现能与硫酸产生气体的只有亚硫酸盐,产生的SO2气体被苛性钠溶液吸收生成亚硫酸盐,亚硫酸盐具有还原性,能被溴水氧化成硫酸盐,与BaCl2溶液产生不溶于盐酸的白色沉淀BaSO4。
本题难度:简单