微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 雷雨中常含有微量的硝酸,对农作物生长有利,试用化学方程式解释硝酸的形成过程:
①?;②? ?;③?。
?;③?。
参考答案:①N2 + O2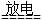 2NO
2NO
②2NO + O2 = 2NO2
③3NO2 + H2O = 2HNO3 + NO
本题解析:略
本题难度:简单
2、选择题 用NA表示阿伏加德罗常数,下列说法中正确的是
A.1mol甲烷的质量与甲烷的摩尔质量相等
B.28g氮气与40g氩气所含的原子数目相等,都是NA个
C.2.3g钠由原子变成离子,失去的电子数为0.1NA

D.18g重水(D2O)所含的电子数为10NA
参考答案:C
本题解析:略
本题难度:一般
3、选择题 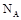 表示阿伏加德罗常数的值。下列说法正确的是
表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为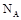
B.标准状况下,22.4L 与水反应生成1mol硫酸
与水反应生成1mol硫酸
C.足量铜与1L 18mol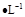 浓硫酸反应可以得到
浓硫酸反应可以得到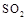 的分子总数为9
的分子总数为9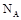
D.标准状况下,22.4L任意比的氢气与氧气的混合气体中含有的分子总数均为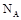
参考答案:D
本题解析:略
本题难度:简单
4、选择题 设NA为阿佛加德罗常数,下列叙述中正确的是
A.标准状况下,22.4LSO2和O2混合气体中含有的氧原子数为2NA
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内气体分子总数为2NA
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
参考答案:AD
本题解析:本题考查阿伏加德罗常数与微粒间的关系,难度中等;标准状况下,22.4L混合气为1mol,其中含有氧原子为2mol,A项正确;0.1mol Fe在0.1mol C12中充分燃烧时,铁过量,氯气完全反应,故转移电子0.2mol,B项错误;SO2与 O2的反应为可逆反应,反应不能进行彻底,容器内分子数大于2NA,C项错误;0.1mol Cl2与足量NaOH溶液常温下反应,转移电子0.1mol,D项正确。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液说法不正确的是(?)
A.500mL溶液中的阴、阳离子总数为0.3NA
B.500mL溶液中NO3— 离子浓度为0.2 mol/L
C.500mL溶液中Ba2+ 离子浓度为0.2mol/L
D.500mL溶液中NO3— 离子总数为0.2NA
参考答案:B
本题解析:Ba(NO3)2在溶液中是完全电离的,方程式为Ba(NO3)2=Ba2++2NO3-。Ba(NO3)2是0.2mol/L,所以电离出的阳离子和阴离子的浓度分别为0.2mol/L和0.4mol/L。因此500mL溶液中NO3— 离子为0.5L×0.4mol/L=0.2mol,Ba2+ 离子0.5L×0.2mol/L=0.1mol。所以选项B是错误的,答案选B。
本题难度:简单