微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
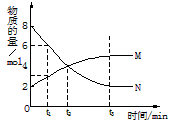
1、选择题 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
[? ]
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
参考答案:D
本题解析:
本题难度:一般
2、选择题 在密闭的容器中进行如下的反应:H2(G+I2(g) 2HI(g),在温度T1和T2时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是(? )
2HI(g),在温度T1和T2时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是(? )
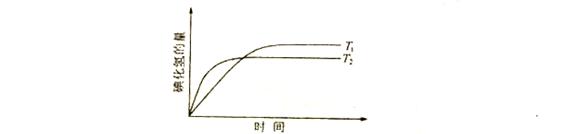
A.T1>T2,△H>0
B.T1>T2,△H<0
C.T1<T2,△H>0
D.T1<T2,△H<0
参考答案:D。
本题解析:根据“先拐现平数字大”的原则,从图可以看出,反应时的温度T2>T1,且温度越高,HI的量越少,说明升高温度,平衡向逆反应方向移动,即该反应的正反应属于放热反应,△H<0。
本题难度:一般
3、选择题 在一个密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是?
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是?
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO3(g)为0.4mol/L
C.SO2、SO3(g)均为0.15mol/L
D.SO2为0.25mol/L
参考答案:D
本题解析:可采用极值法。若全部转化为生成物,则SO3的浓度是0.4mol/L。若全部转化为反应物则SO2、O2的浓度分别为0.4mol/L、0.2mol/L。因为是可逆反应,所以选项A、B不可能。由硫原子守恒可知,SO2和SO3的浓度之和应满足0.4mol/L,即C也不可能。答案是D。
本题难度:简单
4、填空题 党的十八大报告中首次提出“美丽中国”的宏伟目标。节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:

请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中? B.空气氛围中? C.氩气氛围中? D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
?
符合表中的平衡常数x的数值是________(填字母序号)。
A.0? B.0.012? C.32.081? D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
?
| c(CO)
| c(H2)
| c(CH3OH)
|
0 min
| 0.8 mol·L-1
| 1.6 mol·L-1
| 0
|
2 min
| 0.6 mol·L-1
| y
| 0.2 mol·L-1
|
4 min
| 0.3 mol·L-1
| 0.6 mol·L-1
| 0.5 mol·L-1
|
6 min
| 0.3 mol·L-1
| 0.6 mol·L-1
| 0.5 mol·L-1
|
?
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂? B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。
参考答案:(1)Cl2 2H2O+2e-=H2↑+2OH-
(2)进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净 C
(3)①B ②0.3 mol·L-1·min-1 62.5% A
(4)CH3OH+8OH--6e-=CO32—+6H2O
本题解析:(1)装置甲为电解饱和NaCl溶液的装置,阳极为Cl-失电子,被氧化为Cl2,阴极水电离的H+得电子,生成氢气和NaOH。
(2)装置丙和装置戊的作用是提纯Ti。装置戊中发生的反应是钠还原TiCl4的反应,而高温条件下钠与氧气反应,需要无氧和无水环境。
(3)①ΔH<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0。②根据表格中CO或CH3OH的浓度可知y=1.2 mol·L-1,所以反应从2 min到4 min之间,H2的平均反应速率为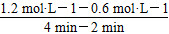 =0.3? mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为
=0.3? mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为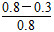 ×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
(4)装置己是由甲醇、氧气、NaOH溶液构成的燃料电池,负极反应为甲醇在碱性条件下失电子的反应。
本题难度:困难
5、选择题 下列反应属于可逆反应的是(?)
A.Cl2溶于水的反应
B.氢气和氧气的反应
C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O
D.实验室加热二氧化锰和浓盐酸的混合物制取氯气的反应
参考答案:A
本题解析:Cl2跟H2O的反应实为可逆反应。
本题难度:简单