微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述不正确的是
A.离子晶体中只含离子键
B.含有离子键的晶体一定是离子晶体
C.离子晶体中可能含共价键
D.离子晶体不一定由金属阳离子和非金属阴离子构成
参考答案:A
本题解析:A、C都可用NaOH这个例子来说明,D可用NH4Cl来说明。
本题难度:简单
2、选择题 下列有关物质性质、结构的表述均正确,且存在因果关系的是(?)
?
| 表述Ⅰ
| 表述Ⅱ
|
A
| 在水中,NaCl的溶解度比I2的溶解度大
| NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力
|
B
| 通常条件下,CH4分子比PbH4分子稳定性高
| Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小
|
C
| 金属晶体具有良好的延展性
| 金属晶体中的原子层可以发生相对滑动但不会改变原来的排列方式,也不会破坏金属键
|
D
| P4O10、C6H12O6溶于水后均不导电
| P4O10、C6H12O6均属于共价化合物
参考答案:BC
本题解析:氯化钠是离子化合物,作用力是离子键,碘是非极性分子,而水是极性分子,依据相似相溶可知,碘在水中的溶解度小,A不正确。P4O10溶于水生成磷酸,可以导电,D不正确。BC都是正确的,答案选BC。
本题难度:一般
3、填空题 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化 合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示) 合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
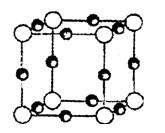
(1)A的简单氢化物分子中其中心原子采取________杂化,E的最高价氧化物分子的空间构型是____________。
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是_____________.
(3)A、B、C、D的第一电离能由小到大的顺序为
_________________。(用元素符号表示)?
(4)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为____________;(每个球均表示1个原子)
(5)F的价电子轨道表示式是______________,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______________________。
参考答案:
本题解析:略
本题难度:一般
4、选择题 下面关于SiO2晶体网状结构的叙述正确的是
[? ]
A.最小的环上,有3个Si原子和3个O原子
B.最小的环上,Si和O原子数之比为1∶2
C.最小的环上,有6个Si原子和6个O原子
D.存在四面体结构单元,O处于中心,Si处于4个顶角
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>碳化硅
B.K>Na>Li
C.NaF<NaCl<NaBr
D.CI4>CBr4>CCl4>CH4
参考答案:D
本题解析:
正确答案:D
A、不正确,硅原子半径大,Si―Si键长长,作用力小,硅晶体熔点低,金刚石>碳化硅>晶体硅;B、从Li―K,半径增大,金属键变弱,熔点变低。C、Br―半径大,离子键晶格能小,熔点低。D、正确,分子晶体,相对分子质量越大,熔点超高。
本题难度:一般
|