微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 写出下列有机反应的化学方程式
(1)实验室制取乙炔:______;
(2)2-溴丙烷与NaOH的醇溶液的反应:______;
(3)向苯酚钠溶液中通入少量的CO2:______;
(4)由甲苯制取TNT:______;
(5)苯甲醇的催化氧化:______.
参考答案:(1)碳化钙和水反应制取乙炔,化学反应为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)2-溴丙烷与NaOH的醇溶液发生消去反应生成丙烯和氯化钠,化学反应为CH3CHBrCH3+NaOH醇
本题解析:
本题难度:一般
2、填空题 漂白粉的有效成分是①______,在使用漂白粉时为了增强漂白效果,可向溶液中滴加少量食醋(主要成分为CH3COOH),其原理用化学方程式表示为②______,如果不滴加食醋照样可以漂白,原理用化学方程式表示为③______.
参考答案:①根据漂白粉是混合物,主要成分是Ca(ClO)2和CaCl2,有效成分是Ca(ClO)2,
故答案为:Ca(ClO)2;
②根据强酸制弱酸的原理,CH3COOH酸性大于HClO,所以Ca(ClO)2+2CH3COOH=(CH3COO)2Ca+2HClO,
故答案为:Ca(ClO)2+2CH3COOH=(CH3COO) 2Ca+2HClO;
③漂白粉的有效成分为Ca(ClO)2,因Ca(ClO)2能与空气中的二氧化碳和水反应生成次氯酸:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
本题解析:
本题难度:一般
3、填空题 已知随着硝酸浓度的不同,Fe与硝酸反应会生成NO或NO2;Fe3+能与Fe发生下列反应:2Fe3++Fe═3Fe2+.现将某铁块与50g溶质的质量分数为63%的硝酸溶液发生反应,若反应中生成的气体均完全逸出并全部收集,请通过计算回答下列问题:
(1)若反应后,铁块全部溶解,硝酸仍有剩余,只收集到NO2气体,其体积在标准状况下为3.36L,则参加反应的Fe质量为______g.
(2)若反应后,硝酸完全消耗,铁块仍有剩余,收集到的气体是NO2和NO的混合气体,其体积在标准状况下也为3.36L,则参加反应的Fe质量为______g.
(3)若该铁块是表面含有Fe2O3的铁块,质量为15g,且该铁块与上述硝酸恰好完全反应.如果将铁块中单质Fe的质量分数设为ω,则ω理论上的最大值是:______.
参考答案:(1)反应后,铁块全部溶解,硝酸仍有剩余,Fe被氧化生成Fe(NO3)3,
生成NO2的物质的量为3.36L22.4L/mol=0.15mol,
根据电子转移守恒,可知n(Fe)=0.15mol×(5-4)3=0.05mol,
故铁的质量为0.05mol×56g/mol=2.8g,
故答案为:2.8;
(2)若反应后,硝酸完全消耗,铁块仍有剩余,Fe被氧化生成Fe(NO3)2,
NO、NO2的总物质的量为3.36L22.4L/mol=0.15mol,
根据氮元素守恒,起酸的作用的硝酸的物质的量为:50g×63%63g/mol-0.15mol=0.35mol,
故参加反应的n(Fe)=0.35mol×12=0.175mol,
参加反应的铁的质量0.175mol×56g/mol=9.8g,
故答案为:9.8;
(3)若该铁块是表面含有Fe2O3的铁块,与上述硝酸恰好完全反应,当反应生成Fe(NO3)2与NO时,铁块中Fe的质量最大,其质量分数最大,发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O、Fe2O3+Fe+6HNO3═3Fe(NO3)2+3H2O,
硝酸的物质的量为:50g×63%63g/mol=0.5mol,
令铁块中Fe、Fe2O3的物质的量分别为xmol、ymol,则:
3Fe+8HNO3 ═3Fe(NO3)2 +2NO↑+4H2O、
(x-y) 83(x-y)
Fe2O3+Fe+6HNO3═3Fe(NO3)2+3H2O,
y y 6y
所以,
本题解析:
本题难度:一般
4、选择题 守恒:如质量守恒,电子守恒,电荷守恒等。下列式子符合守恒思想的是
A.Fe2+ + Cl2 → Fe3+ + 2Cl—
B.4FeS2 + 11O2 → 2Fe2O3 + 8SO2
C.NH3 + H2SO4 → (NH4)2SO4
D.Al3+ + 6OH— → AlO2— + 3H2O
参考答案:B
本题解析:略
本题难度:一般
5、选择题 下列反应不属于氧化还原反应的是
A.3Cl2+6 KOH====5KCl+KClO3+3H2O
KOH====5KCl+KClO3+3H2O
B.2NO2+2NaOH====NaNO3+NaNO2+H2O
C.Fe2O3+2Al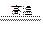 2Fe+Al2O3
2Fe+Al2O3
D.SnCl4+2H2O===SnO2+4HCl
参考答案:D
本题解析:略
本题难度:简单