微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式与所述事实相符且正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3-
D.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-═Mn2++Cl2↑+2H2O
参考答案:B
本题解析:分析:A、Fe(OH)3溶于氢碘酸发生氧化还原反应生成亚铁离子和碘单质;
B、氢氧化铝不溶于弱酸,过量二氧化碳生成碳酸氢根离子;
C、漂白粉溶液在空气中失效是吸收空气中二氧化碳生成碳酸钙沉淀和次氯酸,次氯酸分解生成盐酸和氧气;
D、原子不守恒;
解答:A、Fe(OH)3溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2,故A错误;
B、氢氧化铝不溶于弱酸,过量二氧化碳生成碳酸氢根离子,离子方程式为Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;故B正确;
C、漂白粉溶液在空气中失效是吸收空气中二氧化碳生成碳酸钙沉淀和次氯酸,次氯酸分解生成盐酸和氧气Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故C错误;
D、用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,故D错误;
故选B.
点评:本题考查了离子方程式书写方法和注意问题,主要考查氧化还原反应关系判断,氢氧化铝不溶于弱酸性质应用,离子方程式原子守恒分析,题目难度中等.
本题难度:一般
2、填空题 (4分)某些共价键的键能数据如下(单位:kJ/mol)
共价键
| H-H
| Cl-Cl
| Br-Br
| H-Cl
| H-I
| I-I
| N≡N
| H-O
| H-N
|
键?能
| 436
| 247
| 193
| 431
| 299
| 151
| 946
| 463
| 391
|
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应中的能量变化:(填“吸收”或“放出”)? kJ能量。
参考答案:(1)吸收;247?(2)放出179
本题解析:(1)断键是吸热的,根据键能可知,把1molCl2分解为气态原子时,需要247kJ的能量。
(2)反应热就是断键吸收的总能量和形成化学键所放出的总能量的差值,即436 kJ/mol+247 kJ/mol-2×431 kJ/mol=-179 kJ/mol,即是放热反应。
本题难度:一般
3、选择题 下列物质在变化过程中,只需克服分子间作用力的是
A.食盐溶解
B.干冰升华
C.氯化铵受热,固体消失
D.金刚石熔化
参考答案:B
本题解析:氯化钠是离子化合物,溶于水克服的是离子键。CO2是分子晶体,干冰升华克服分子间作用力。C发生化学变化,克服化学键。金刚石是原子晶体,熔化克服非极性键。答案选B。
本题难度:简单
4、选择题 下列说法不正确的是(? )
A.含有非极性共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价健一定是非极性键
参考答案:A
本题解析:含有非极性共价键的化合物不一定是共价化合物,例如过氧化钠中含有非极性键,属于离子化合物,A不正确;全部由共价键形成的化合物是共价化合物,B正确;含有离子键的化合物一定是离子化合物,C正确;同一种非金属元素的原子之间形成的化学键是非极性键,D正确,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查。难度不大,主要是考查学生对化学键知识的了解掌握程度。该题的关键是明确化学键和化合物的关系,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和灵活应变能力。
本题难度:一般
5、选择题 已知反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1和2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1。则下列说法不正确的是
A.CO转化为CO2的热化学方程式为2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ·mol-1
B.CO燃烧热的热化学方程式为CO(g)+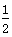 O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
C.放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行
D.1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ