微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
A.是Fe3+和Cu2+
B.是Fe2+和Cu2+
C.是Fe2+和Fe3+
D.只有Fe2+
参考答案:D
本题解析:表面的氧化物的量较少,溶于盐酸后,生成的Cu2+和Fe3+也较少,分别被单质铁还原为Cu和Fe2+,铜与盐酸不反应,铁与盐酸反应生成Fe2+。
本题难度:简单
2、选择题 铁和铁的合金是生活中常用的材料,下列说法正确的是( )
A.一定条件下,铁粉可与水蒸气反应
B.不锈钢是铁的合金,只含金属元素
C.铁与盐酸反应,铁的合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
参考答案:A
本题解析:A 对,在高温下能反应
B 错不锈钢中还含有非金属元素碳元素
C 错 铁和铁的合金都可与盐酸反应
D 错 镀锌铁板,锌做负极,铁做正极,所以,镀锌铁板比铁板更耐腐蚀
本题难度:简单
3、实验题 (14分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
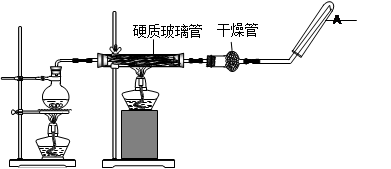
(1)写出该反应的反应方程式?;并指明该氧化还原反应的还原剂是?(填化学式,下同),氧化剂是?。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶底部放置了几片碎瓷片,其作用是? ?。
(3)试管中收集气体是?(填化学式),如果要在A处玻璃管处点燃该气体,则必须对该气体进行?。
(4)该同学欲确定反应后硬质试管中还原铁粉是否完全反应,其中的固体成分有哪些,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质一定有?,若溶液未变红色则说明硬质试管中固体物质的成分是?。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)。
参考答案:(1)3Fe+4H2O(g) 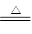 ?Fe3O4+4H2 (2分),Fe (1分), H2O(1分)?
?Fe3O4+4H2 (2分),Fe (1分), H2O(1分)?
(2)为硬质玻璃管内Fe与水蒸气的反应,提供持续不断的水蒸气(2分)防止爆沸(2分)
(3)H2 (1分)?验纯(1分)
(4)一定有Fe3O4(1分)? Fe3O4和Fe(1分)
(5)Fe + 2Fe3+= 3Fe2+(2分)
本题解析:(1)铁粉与水蒸气高温反应的化学方程式为:3Fe+4H2O(g) 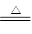 ?Fe3O4+4H2;反应的过程中铁元素化合价升高,为还原剂;水中所含元素化合价降低,为氧化剂;
?Fe3O4+4H2;反应的过程中铁元素化合价升高,为还原剂;水中所含元素化合价降低,为氧化剂;
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是:为硬质玻璃管内Fe与水蒸气的反应,提供持续不断的水蒸气;烧瓶底部放置了几片碎瓷片,其作用是:防止爆沸;
(3)试管中收集气体是氢气;如果要在A处玻璃管处点燃该气体,则必须对该气体进行验纯;
(4)取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质一定有一定有Fe3O4;若溶液未变红色则说明硬质试管中固体物质的成分是Fe3O4和Fe;
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:Fe + 2Fe3+= 3Fe2+
本题难度:简单
4、选择题 某溶液中滴入KSCN溶液后变红,说明该溶液中存在
A.NO3-
B.Fe3+
C.SO42-
D.Mg2+
参考答案:B
本题解析:某溶液中滴入KSCN溶液后变红则溶液中有Fe3+;检验Fe3+的方法;
本题难度:一般
5、填空题 现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为__________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe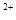 、Cu
、Cu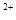 时,则b的取值范围是(用a、x表示)___________。
时,则b的取值范围是(用a、x表示)___________。
(3)当x=0.5,溶液中Fe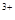 与Fe
与Fe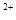 的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
参考答案:(1)? Fe2+或Fe2+、Cu2+ (2分)
(2) 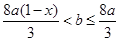 ?(2分)
?(2分)
(3)? a=0.04mol? b=0.12mol (2分)
本题解析:(1) Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:
①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,溶液可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu恰好与硝酸生成Cu2+,所以溶液中存在的离子是Fe2+、Cu2+;
⑤通过④知,固体没有剩余时,生成的Fe3+部分反应,根据离子共存,溶液中存在的离子可能的Fe2+、Fe3+、Cu2+;
⑥通过④、⑤知,固体没有剩余时,铁、铜全部被氧化成离子,根据离子共存,溶液中存在的离子可能是Cu2+、Fe3+;
有如下情况:
残留固体成分
Fe、Cu
Cu
Cu
--
--
__
溶液中的金属离子
Fe2+
Fe2+
Fe2+、Cu2+
Fe2+、Cu2+
Fe2+、Fe3+、Cu2+
Cu2+、Fe3+
?
(2)当溶液金属离子只有Fe2+、Cu2+时,说明Cu恰好完全反应或者有剩余,而HNO3和Fe则完全反应(否则的话,如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+;如果有Fe剩余,则会和Cu2+继续反应)
3Cu+8HNO3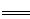 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
ax?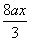
3Fe? +? 8HNO3 3Fe(NO3)2+2NO↑+ 4H2O?
3Fe(NO3)2+2NO↑+ 4H2O?
a(1-x)?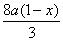
总耗用硝酸量:n(HNO3)=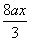 +
+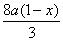 ?=
?=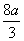
所以: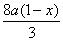 <b≤
<b≤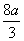
(3)当溶液中为Fe3+、Fe2+时,说明Cu、Fe完全反应(如果未完全反应,则Cu和Fe会和Fe3+反应),并且HNO3也完全反应没有剩余(如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+)溶液中Fe3+、Fe2+的物质的量相等,说明有一半Fe变为Fe3+,一半变为Fe2+
当x=0.5,nFe3+=nFe2+? V(NO)=0.672L
则nFe3+=nFe2+="0.25a" mol? nCu = 0.5amol
此时3Fe+8HNO3 3Fe(NO3)2+2NO↑+4H2O?①
3Fe(NO3)2+2NO↑+4H2O?①
3Cu+8HNO3 3 Cu (NO3)2+2NO+4H2O?②
3 Cu (NO3)2+2NO+4H2O?②
3Fe(NO3)2+4HNO3 3Fe(NO3)3+NO+2H2O?③
3Fe(NO3)3+NO+2H2O?③
反应均发生了,且无反应物剩余。
3Fe?+? 8HNO3 3Fe(NO3)2+2NO↑+4H2O?①?
3Fe(NO3)2+2NO↑+4H2O?①?
0.5a? 0.5a×8/3? 0.5a? 0.5a×2/3
3Cu+8HNO3? ?3 Cu (NO3)2+2NO↑+4H2O?②?
?3 Cu (NO3)2+2NO↑+4H2O?②?
0.5a? 0.5a×8/3? 0.5a? 0.5a×2/3?
3Fe(NO3)2+4HNO3 ?3Fe(NO3)3+NO+2H2O?③
?3Fe(NO3)3+NO+2H2O?③
0.25a? 0.25a ×4/3? 0.25a
0.5a×2/3 +0.5a×2/3 + 0.25a×1/3 =0.672L/22.4L·mol-1=0.03mol
解得:a="0.04" mol?
b=" 0.5a×8/3" + 0.5a×8/3+0.25a ×4/3="3a=3×0.04" mol ="0.12" mol
本题难度:一般