微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C―比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A元素的名称是_______;
(2)C―的结构示意图为?;D元素在周期表中的位置是__________;
(3)元素D的气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_______,若反应中有0.25mol氧化铁参加反应反应中转移电子的个数为__________;
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材
料是_______(用化学式填写),负极电极反应是___________________________________。
参考答案:(1)镁? (2) 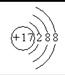 ;第二周期、ⅣA? (3)
;第二周期、ⅣA? (3)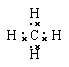 、正四面体? HCl?
、正四面体? HCl?
(4) MgCl2(熔融) Mg+Cl2↑?(5)Fe2O3+2Al
Mg+Cl2↑?(5)Fe2O3+2Al Al2O3+2Fe? 9.03×1023
Al2O3+2Fe? 9.03×1023
(6)Mg? 2Al-6e-+8OH-=2AlO2-+4H2O
本题解析:根据元素的性质和在周期表中的位置可知,B是铝元素,D是碳元素。0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,说明A的最高价是+2价。100ml 0.2mol/L的盐酸是0.02mol,所以氧化物的物质的量是0.01mol,乙醇相对分子质量是40,即A的质量数是24. A原子核内质子数目与中子数目相等,所以A是镁,则C是氯元素。
(3)甲烷是具有正四面体结构分子,其电子式为 。甲烷中含有4个氢原子,所以生成物中含量最多的是氯化氢。
。甲烷中含有4个氢原子,所以生成物中含量最多的是氯化氢。
(4)镁是活泼的金属,通过电解熔融的氯化镁生成镁,方程式为MgCl2(熔融)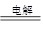 Mg+Cl2↑。
Mg+Cl2↑。
(5)铝是活泼的金属,发生铝热反应的方程式为Fe2O3+2Al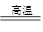 Al2O3+2Fe。氧化铁中铁的化合价是+3价的,所以0.25mol氧化铁参加反应转移的电子为0.25mol×3×2=1.5mol,其电子数为1.5mol×6.02×1023=9.03×1023。
Al2O3+2Fe。氧化铁中铁的化合价是+3价的,所以0.25mol氧化铁参加反应转移的电子为0.25mol×3×2=1.5mol,其电子数为1.5mol×6.02×1023=9.03×1023。
(6)由于铝和氢氧化钠溶液反应,所以作负极是铝,镁作正极。负极反应式为2Al-6e-+8OH-=2AlO2-+4H2O。
本题难度:一般
2、填空题 (6分)? A、B、C三种元素都是短周期元素。含有A元素的物质,在无色火焰上灼烧时产生黄色火焰;B2是自然界中最轻的气体, A元素与C元素位于同一周期,B2在C2中燃烧产生苍白色火焰,且可形成共价化合物。根据以上条件回答:
① 写出A、B的元素符号:A?,B?。
② 写出C元素最高价氧化物对应水化物的化学式?。
参考答案:(6分)
①? Na ,? H②? HClO4
本题解析:焰色反应为黄色的物质中必含有Na元素;B2是自然界中最轻的气体,即为H2;燃烧时产生苍白色火焰的为H2与CL2反应;
C元素为CL元素,其最高价为+7价,对应的氧化物化学式为HClO4
本题难度:简单
3、选择题 X、Y、Z、W、R五种短周期元素在元素周期表中的位置如图所示,下列有关说法一定正确的是
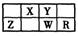
A.非金属性的强弱顺序:Y>W>R
B.X、Y的气态氢化物的稳定性:X>Y
C.原子半径的大小顺序:Z>W>Y
D .W、R的最高价氧化物对应水化物的酸性:W>R
.W、R的最高价氧化物对应水化物的酸性:W>R
参考答案:C
本题解析:略
本题难度:简单
4、填空题 (1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是?;只含有极性键的是?;只含有离子键的是?;既含有非极性键又含有极性键的是?;含有非极性键的离子化合物是?。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的?键更稳定(填“σ”或“π”)。
参考答案:(9分)(1)F? 1s2? 3s23p5?(2)①;②;④;⑤;⑥?(3)π (各1分)
本题解析:(1)非金属性越强,电负性越大,所以电负性最大的是F。He最外层电子数只有2个,稳定性强,第一电离能最大,则基态原子核外电子排布式是1s2。同周期自左向右,原子半径逐渐减小,所以第三周期原子半径最小的元素是氯元素,其价电子排布式是3s23p5。
(2)一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是由同一种非金属的原子之间形成共价键,是非极性键,由不同种非金属的原子之间形成共价键,是极性键,所以只含有非极性键的是氮气;只含有极性键的是水;只含有离子键的是氯化镁;既含有非极性键又含有极性键的是乙烯;含有非极性键的离子化合物是过氧化钠,氢氧化钠是含有离子键和极性键的离子化合物。
(3)氮气中的三键是由1个δ键和2个π键构成的,所以根据N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1可知,π键键能是(942kJ/mol-247kJ/mol)÷2=347.5 kJ/mol>247kJ/mol,所以π键稳定。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用物质结构知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力,提高学生的学科素养。
本题难度:一般
5、填空题 (8分)原子结构与元素周期表存在着内在联系。根据已学原子结构及晶体知识,请回答下列问题:
(1)具有(n-1)d10ns2电子构型的元素位于周期表中?族。
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:?。
(3)写出铝元素原子的核外电子排布式?。
(4)写出3p轨道上有2个未成对电子的元素的符号:?。
参考答案:(共8分,每空2分)(1)ⅡB?(2)3d24s2? (3)1s22s22p63s23p1? (4)? Si? S
本题解析:(1)根据价电子的排布式可知,该元素应该位于第ⅡB。
(2)钛的原子序数是22,所以根据构造原理可知,该元素原子的价电子排布式是
1s22s22p63s23p13d24s2。
(3)根据构造原理可知,3p轨道上有2个未成对电子的元素是Si或S。
本题难度:一般