微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 海洋约占地球表面积的71%,具有十分巨大的开发潜力.某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究.
(1)实验时若用托盘天平配制500mL0.20mol/LNaOH溶液,计算称量固体NaOH的质量.
(2)取初步净化处理的浓缩海水100mL,加入200mL0.20mol/LNaOH溶液,恰好把其中的Mg2+完全沉淀,则浓缩海水中Mg2+的物质的量浓度为多少?
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得标准状况下Cl2多少升?
参考答案:(1)氢氧化钠的物质的量n(NaOH)=C(NaOH)×V=0.20mol/L×0.5L=0.10mol,
固体NaOH的质量m(NaOH)=n(NaOH)?M(NaOH)═0.10mol×40g/mol=4.0g,
答:固体NaOH的质量为4.0g;?
(2)设氢氧化镁的物质的量为x.
? MgCl2 +2NaOH═Mg(OH)2↓+2NaCl
? 1? 2
?x? ?0.20L×0.20mol/L
? ?1x=20.20L×0.20mol/L
? x=0.02mol
?所以c(Mg2+)=0.02mol?0.1L=0.2mol/L?
答:浓缩海水中Mg2+的物质的量浓度为0.2mol/L;
(3)设氯气的物质的量为y.
? MgCl2(熔融)??通电?.? Mg+Cl2↑
? ?1? 1
? 0.02mol? y
? 1?0.02mol=1y
? y=0.02mol
? V(Cl2)=0.02mol/L×0.1L×22.4L/mol=0.448L?
答:可得标准状况下氯气0.448L.
本题解析:
本题难度:一般
2、选择题 下表中对离子方程式书写的评价正确的是
[? ]
化学反应与离子方程式
评价
A.
将铜屑加入含Fe3+溶液中:Fe3++Cu=Fe2++Cu2+
正确
B.
Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑
错误,氧元素不守恒
C.
NaOH溶液与氧化铝反应:Al2O3+2OH-=2AlO2-+H2O
错误,产物应该是Al(OH)3
D.
向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
正确
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列离子方程式书写正确的是
[? ]
A.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓
B.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH- NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D.硫酸铜与烧碱反应: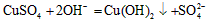
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列各反应的离子方程式中,书写正确的是(? )
A. NaOH溶液与HCl反应: H+ + OH- = H2O
B. FeCl3和Fe反应: Fe3+ +Fe = 2Fe2+
C.硫酸和氢氧化钡反应: H+ + SO42- + Ba2+ +OH- = H2O + BaSO4↓
D.氧化铜和稀盐酸反应: CuO + 2H+ = Cu2+ + H2O
参考答案:AD
本题解析:A 对
B 错 电荷不守恒
C 错 2H+ + SO42- + Ba2+ +2OH- = 2H2O + BaSO4↓
D 对
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式是?
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++ 4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2: OH-+CO2= HCO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
参考答案:D
本题解析:A项,稀硝酸具有氧化性,可氧化二价铁,同时生成NO气体。应该为:3Fe3O4+NO3-+28H+=9Fe3++ NO+14H2O,A错。
B项,Ba(OH)2溶液足量,故HCO3-与铵根离子都能与氢氧根离子反应。B错。
C项,二氧化碳少量时应生成正盐碳酸钙,量多时才生成酸式盐。C错。
D项,NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量之比为2:3, 2mol Al3+恰与6mol OH-反应生成氢氧化铝沉淀,而NH4+因氢氧根离子不足不能反应,3mol Ba2+只能消耗3mol SO42-,SO42-没有完全参与离子反应。D对。
故选D
本题难度:一般