微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 中华民族在世界冶金史上曾谱写过辉煌的篇章,早在两千多年前的西汉时期就有“曾青得铁则化为铜”的记载,这种方法是现代湿法冶金的先驱.硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,该反应的化学方程式为Fe+CuSO4=Cu+FeSO4.其中被还原的元素是______,被氧化的元素是______,氧化剂是______,还原剂是______,氧化产物是______,还原产物是______,每得到128克铜时,转移电子数目为______.
参考答案:Fe+CuSO4=Cu+FeSO4中,铁元素的化合价由0价→+2价,铜元素的化合价由+2价→0价,所以铁是还原剂,硫酸铜是氧化剂,铜元素被还原,铁元素被氧化,硫酸亚铁是氧化产物,铜是还原产物,每生成64g铜转移2NA个电子,则每得到128克铜时,转移电子数目为4NA,
故答案为:Cu;Fe;CuSO4;Fe;FeSO4;Cu;4NA.
本题解析:
本题难度:一般
2、选择题 下列一步转化中,一定要加入氧化剂才能实现的是( )
A.SiO2→Na2SiO3
B.Na2O2→NaOH
C.N2→NH3
D.NH3→NO
参考答案:A.SiO2→Na2SiO3的反应中元素的化合价没有发生变化,不是氧化还原反应,故A错误;
B.Na2O2→NaOH,可与水反应,Na2O2自身发生氧化还原反应,无须加入氧化剂,故B错误;
C.N2→NH3,N元素化合价降低,被还原,应加入还原剂,故C错误;
D.NH3→NO,N元素化合价升高,被氧化,应加入氧化剂,故D正确.
故选D.
本题解析:
本题难度:简单
3、简答题 间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与?I-作用定量析出?I2;I2溶于过量的KI溶液中:I2+I-═I3-;且在溶液中:Fe3++6F-=[FeF6]3-(?六氟合铁(III)络离子?)
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
现准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是______;
(2)实验中加入稀硫酸,你认为硫酸的作用是______;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为______;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:______;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=______%.
参考答案:(1)胆矾加酸溶解后溶液中含有Fe3+,Fe3+能氧化I-生成I2,造成Cu的质量偏大,影响测定结果,加入少量NaF,发生反应Fe3++6F-=[FeF6]3-,FeF63-不能氧化I-,
故答案为:掩蔽Fe3+,防止造成偏大的误差;
(2)Cu2+能发生水解反应溶液呈酸性,提供酸性条件,抑制Cu2+的水解,故答案为:提供酸性条件,抑制Cu2+的水解;
(3)用碘量瓶溶液不与空气中氧气接触,而用普通锥形瓶能与空气中氧气接触,氧气能与碘化钾反应生成单质碘,所以用碘量瓶防止空气中的氧气与碘化钾反应,
故答案为:防止空气中的氧气与碘化钾反应;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,离子方程式为:2Cu2++4I-=2CuI↓+I2,故答案为:2Cu2++4I-=2CuI↓+I2;
(5)Na2S2O3标准溶液的物质的量为cmol/L×V×10-3L,由关系式:2Cu2+~I2~I3-~2S2O32-,可知:Cu2+的物质的量为cmol/L×V×10-3L,
Cu2+的质量为:cmol/L×V×10-3L×64g/mol,所以ω(Cu)=cmol/L×V×10-3L×64g/molag×100%=64cV1000a×100%,
故答案为:64cV1000a×100%.
本题解析:
本题难度:一般
4、填空题 用双线桥法标明下列化学方程式中电子转移的方向和数目并分析下列氧化还原反应,完成下列填空.
(1)2Al+Fe2O3
Al2O3+2Fe
氧化剂为______,氧化产物为______,0.4molAl参加反应时,转移的电子数目是______NA.
(2)2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O
被氧化的元素的原子结构示意图为______,氧化性:KMnO4______Cl2(填“<”、“>”或“=”).
参考答案:(1)Fe2O3+3Al高温.Al2O3+3Fe中Fe元素化合价降低,被还原,Fe2O3为氧化剂,Al元素化合价升高,被氧化,为还原剂,则Fe得到2×3e-,Al失去2×3e-,氧化产物为Al2O3,电子转移数目和方向可表示为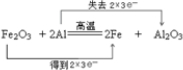 ,0.4mol Al参加反应时,转移的电子数目是1.2NA.
,0.4mol Al参加反应时,转移的电子数目是1.2NA.
故答案为:Fe2O3;Al2O3;1.2; ;
;
(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,Cl元素被氧化,失去的电子为5×2×(1-0)e-=10e-,双线桥标出反应中电子的转移方向和数目为 ,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为
,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为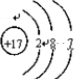 ,
,
故答案为: ;>;
;>; .
.
本题解析:
本题难度:一般
5、简答题 (1)0.6mol的氧气与0.4mol臭氧?O3质量之比为______,分子个数之为______,原子个数之比为______.
(2)在Fe3O4+4CO
3Fe+4CO2的中,______是氧化剂,______是还原剂,______元素被氧化.
(3)除去括号中杂质,写出所加试剂与反应的离子方程式.
SO42-(CO32-),所加试剂:______,离子方程式:______.
Fe2+(Cu2+),所加试剂:______,离子方程式:______.
(4)写出下列反应的离子方程式
氧化铁和盐酸反应______
碳酸钙跟盐酸反应______
锌和硫酸铜溶液反应______.
参考答案:解(1)m(O2)=nM=0.6mol×32g/mol=19.2g; m(O3)=nM=0.4mol×48g/mol=19.2g? 所以m(O2):m(O3)=19.2g:19.2g=1:1;
N(O2)=nNA=0.6NA;? N(O3)=nNA=0.4NA,所以N(O2):N(O3)=0.6NA:0.4NA=3:2;
每个氧气分子中含有2个氧原子,每个臭氧分子中含有3个氧原子,所以原子个数比为(3×2):(2×3)=1:1;
故答案为:1:1; ?3:2; ?1:1.
(2)Fe3O4+4CO?高温?.?3Fe+4CO2,该反应中的化合价变化为Fe3O4 →Fe,铁元素由+83价→0价,得电子化合价降低,所以Fe3O4 是氧化剂;CO→CO2,C元素由+2价→+4价,失电子化合价升高,所以CO是还原剂,C元素被氧化;
故答案为:Fe3O4;CO;C.
(3)除去CO32-且不引进新的杂质离子,所以选取的试剂为H2SO4 ;H2SO4和CO32-反应生成水和二氧化碳;除去二价铁离子中的铜离子,所选试剂和铜离子反应生成二价铁离子,所以选Fe,Fe和铜离子反应生成二价铁离子和铜;
故答案为:H2SO4 ;CO32-+2H+═H2O+CO2↑;Fe;?Fe+Cu2+═Fe2++Cu.
(4)书写离子方程式时,单质、沉淀、弱电解质、气体、氧化物写化学式,可溶性的强电解质写离子;
氧化铁和盐酸反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O
碳酸钙和盐酸反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑
锌和硫酸铜溶液反应的离子方程式为:Zn+Cu2+═Zn2++Cu?
故答案为:Fe2O3+6H+═2Fe3++3H2O
CaCO3+2H+=Ca2++H2O+CO2↑
Zn+Cu2+═Zn2++Cu
本题解析:
本题难度:一般