微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:H(g) + H(g) = H2(g)? ΔH=-435.7kJ/mol,此热化学方程式包含的意义是
A.氢原子的能量比氢分子的能量低
B.两个氢原子结合成一个氢分子时放出435.7kJ能量
C.1mol氢分子分解成2mol氢原子要吸收435.7kJ能量
D.2mol氢原子结合1mol氢分子成要吸收435.7kJ能量
参考答案:C
本题解析:因为氢原子生成氢分子放热,故氢原子的能量比氢分子的能量高,A说法不正确;热反应方程式物质前的计量数表示的是物质的量,即1mol氢分子分解成2mol氢原子要吸收435.7kJ能量,B D不正确,C正确。
本题难度:简单
2、选择题 下列与化学反应原理相关的叙述不正确的是( )
A.放热反应中生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.盖斯定律实质上是能量守恒定律的体现
D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡
参考答案:A.生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,所以放热反应中生成物总能量一定低于反应物总能量,故A正确;
B.反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故B错误;
C.反应的热效应只与始态、终态有关,与过程无关,所以盖斯定律实质上是能量守恒定律的体现,故C正确;
D.电离平衡、水解平衡和沉淀溶解平衡等在平衡时正逆两个过程仍在进行,两个方向的速率不为零,是动态平衡,故D正确;
故选B.
本题解析:
本题难度:简单
3、选择题 下列说法中正确的是( )
A.由H原子形成1molH-H键要吸收热量
B.所有燃烧反应都是放热反应
C.在稀溶液中,1mol酸与1mol碱发生中和反应生成水时所释放的热量称为中和热
D.凡经加热而发生的化学反应都是吸热反应
参考答案:A、由原子形成化学键放出能量,故A错误;
B、燃烧是指发光发热的剧烈的氧化还原反应,故B正确;
C、根据中和反应概念,中和反应强调生成1mol水放出的热量为中和热,故C错误;
D、吸热反应和放热反应与化学键的断裂和形成的能量差有关,与反应条件无关,故D错误.
故选B.
本题解析:
本题难度:简单
4、简答题 (16分)最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是?
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/ mol/L
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中的数据判断该试样的酸碱性为?,其pH=?。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式?。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1?
2NO(g) △H=+180.5kJ·mol-1?
ⅱ? 2C(s)+ O2(g) 2CO(g)?△H ="-" 221.0 kJ·mol-1
2CO(g)?△H ="-" 221.0 kJ·mol-1
ⅲ?C(s)+ O2(g) CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数?。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式?。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
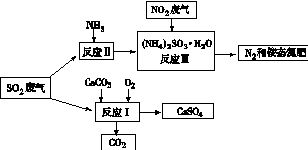
①写出反应Ⅰ的化学方程式:?。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是?。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是?。
参考答案:(16分)
(1)b、c?(2分)
(2)酸性? 4?(各1分,共2分)
(3) ①? 3NO2 + H2O = 2HNO3 + NO?(2分)
②减小?(2分)
2NO (g)+2 CO (g) =N2(g)+2CO2(g)?△H ="-" 746.5kJ/mol?(2分)
(4)①?2CaCO3 +O2 +2SO2= 2CaSO4 + 2CO2 ?(2分)
②防止亚硫酸铵(NH4) 2 SO3被氧化?(2分)
③盐酸和氯化钡(HCl 和 BaCl2)?(2分)
本题解析:(1)a、PM2.5是指微粒直径≤2.5×10-6米的微粒,而胶粒直径为1~100nm,即在10-9~10-7米之间,故在空气中不只形成了胶体,还有浊液,故a错误;b.PM2.5直径小,表面积大,能吸附大量有毒、有害物质,故b正确;c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染,故c正确,答案选bc;
(2)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性.试样的pH值根据溶液中电荷守恒得c(K+)+c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)计算c(H+)= 10-4mol/L,pH值为4;
(3)①NO2转化为HNO3的化学方程式为:3NO2+H2O=2HNO3+NO;
②ⅰN2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1?①
ⅱ2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1?②
ⅲC(s)+O2(g)═CO2(?g)△H=-393.5kJ?mol-1?③
反应ⅲ正反应放热,温度升高平衡逆向移动,反应物浓度增大,生成物浓度减小,化学平衡常数减小;
由盖斯定律,NO(g)和CO(g)反应生成N2(g)、CO2(g)的热化学方程式可由③×2-①-②得到,即2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol;
(4)①根据反应物和生成物,写出反应Ⅰ的化学方程式为:2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亚硫酸根离子易被空气中的氧气氧化,所以向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡(HCl和BaCl2)。
本题难度:一般
5、填空题 (10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ
| 用炭粉在高温条件下还原CuO
|
方法Ⅱ
| 电解法,反应为2Cu + H2O 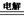 ?Cu2O + H2↑。 ?Cu2O + H2↑。
|
方法Ⅲ
| 用肼(N2H4)还原新制Cu(OH)2
|
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是? ▲?。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s)? △H = -169kJ·mol-1
C(s)+1/2O2(g)="CO(g)?" △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)="CuO(s)?" △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =? ▲ ?kJ·mol-1。
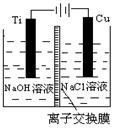
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为?▲?。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放 出N2。该制法的化学方程式为? ▲?。
出N2。该制法的化学方程式为? ▲?。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: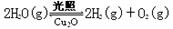 △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是? ▲?(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1 min—1 ?
C.实验②比实验①所用的催化剂催化效率高
参考答案:(每空2分,共10分)(1)反应不易控制,易还原产生Cu?
(2)+34.5?(3)2Cu-2e-+2OH-=Cu2O+H2O
(4)4Cu(OH)2 + N2H4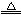 2Cu2O + N2↑ + 6H2O?(5)BC
2Cu2O + N2↑ + 6H2O?(5)BC
本题解析:略
本题难度:一般