微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置能够组成原电池的是( )
A.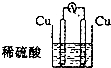
B.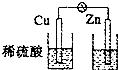
C.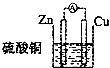
D.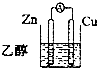
参考答案:A.两个电极材料相同,Cu与稀硫酸不反应,不能组成原电池,故A错误;
B.不能形成闭合回路,不能组成原电池,故B错误;
C.符合原电池的构成条件,发生Zn+CuSO4=ZnSO4+Cu的电池反应,故C正确;
D.乙醇为非电解质,不导电,不能组成原电池,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 对原电池的电极名称,下列叙述中错误的是( )
A.电子流入的一极为正极
B.比较不活泼的一极为正极
C.电子流出的一极为负极
D.发生氧化反应的一极为正极
参考答案:A、原电池中,电子从负极沿导线流向正极,所以电子流入的一极为正极,故A正确.
B、原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,所以较活泼的金属作负极,较不活泼的电极为正极,故B正确.
C、原电池中,电子从负极沿导线流向正极,所以电子流出的一极为负极,故C正确.
D、电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,故D错误.
故选D.
本题解析:
本题难度:简单
3、填空题 北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
参考答案:(1)2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1(热化学方程式和反应热各1分)
(2)318.1 kJ(未写单位不得分)
(3)N2H4-4e-+4OH- = N2+4H2O O2+4e-+2H2O = 4OH-
(4)2NH3+ClO-= N2H4+Cl-+H2O
本题解析:(1)已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。则2mol液态肼放出的热量为219.3 kJ×5=1096.5 kJ
所以反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
所以有反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(l) ΔH=-1272.5kJ·mol-1
16 g气态肼的物质的量="16g/32g/mol=0.5mol," 放出的热量Q=1272.5 kJ /4="318.1" kJ
(3)由肼和空气构成的碱性燃料电池的负极反应式为:N2H4-4e-+4OH- = N2+4H2O 正极反应式为:O2+4e-+2H2O = 4OH-
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼, 次氯酸钠是氧化剂,被还原为氯化钠,氨气做还原剂,被氧化为肼。2NH3+ClO-= N2H4+Cl-+H2O
考点:热化学方程式的书写,电极反应式的书写。
本题难度:一般
4、简答题 (Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.
(1)若A接E,B接F,而B电极出现______,反应式为______,则说明F为正极;
(2)铅蓄电池工作时(放电),其E所在电极的电极反应式为:______,充电时该极与外加电源的______极相连;
(3)若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是______;
(Ⅱ)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时,其负极方程式(写离子方程式)为______.
(Ⅲ)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH+H2O→CH3COOH+4H++4e-.正极的反应式:______;电池反应的总方程式为:______.
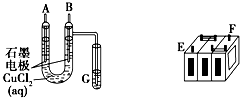
参考答案:(Ⅰ)(1)与原电池正极相连的为电解池的阳极,所以B为阳极,氯离子在阳极失电子,生成氯气,即在B电极出现黄绿色气体,其电极反应式为2Cl--2e-=Cl2↑,
故答案为:黄绿色气气体产生;2Cl--2e-=Cl2↑;
(2)铅蓄电池工作时负极为Pb失电子,则其电极反应式为:Pb+SO42--2e-=PbSO4;充电时蓄电池的负极与外接电源的负极相连,
故答案为:Pb+SO42--2e-=PbSO4;负;
(3)正极上PbO2→PbSO4,Pb元素从+4降低到+2,转移2个电子,所以若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是0.1mol,
故答案为:0.1mol;
(II)碱性条件下,负极上甲醇失电子生成碳酸根离子,则其电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(III)酸性燃料电池中氧气在正极得电子生成水,其电极反应式为:O2+4H++4e-=2H2O,正极的电极反应式与和负极的电极反应式相加即是总反应,所以电池反应的总方程式为:CH3CH2OH+O2=CH3COOH+H2O,故答案为:O2+4H++4e-=2H2O;CH3CH2OH+O2=CH3COOH+H2O.
本题解析:
本题难度:一般
5、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
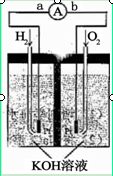
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
参考答案:(1)由化学能转变为电能(1分) 由a到b(1分)
(2)2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O(2分)
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或增大电极上H2、O2气体的浓度,加快反应速率。(2分)
(4)①Li(1分) H2O (1分) ②16(2分)
本题解析:
试题解析:(1)氢氧燃料电池是利用了原电池的工作原理,所以是把化学能转化为电能的装置。在装置中,电子的流向是从负极流向正极,图中a为负极,b为正极,所以电子从a流向b。
(2)负极是氢气发生氧化反应,结合电解质溶液,电极反应式为2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O。
(3)由题目中所述,铂吸附气体的能力强,性质稳定,所以电极表面镀铂粉的目的是增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或者是增大电极上H2、O2气体的浓度,加快反应速率。
(4)①还原剂是指元素化合价升高的物质,在Ⅰ中Li的化合价升高,所以Li是还原剂;氧化剂是指元素化合价降低的物质,在Ⅱ中H2O中氢元素的化合价降低,所以H2O作氧化剂。
②放出的H2的物质的量为10mol,由于能量转化率为80%,实际参加反应的H2的物质的量为10mol×80%=8mol, H2的物质的量为8mol, H2-2e-=2H+则导线上通过的电子的物质的量为8mol×2=16mol。
考点:考查氢氧燃料电池的工作原理、电子流向、相应计算
本题难度:一般