微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置中,能组成原电池的是:( ) 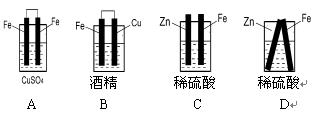
参考答案:D
本题解析:略
本题难度:一般
2、填空题 请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
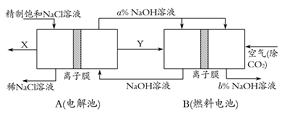
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
参考答案:(1)k=Mr(Cl2)/2Mr(NaOH)=71/80=1∶1.13或0.89
(2)③①②
(3)①Cl2 H2 a%<b%
②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O
③燃料电池可以补充电解池消耗的电能 提高产出碱液的浓度,降低能耗(其他合理答案也可)
本题解析:(1)据化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可计算出k值.
2NaOH+H2↑+Cl2↑即可计算出k值.
(2)把Na2CO3放在BaCl2之后,以除去过量的Ba2+;把盐酸放在NO2CO3之后,以除去过量的CO32-。
(3)判断出二极是解答二池问题的前提:燃料电池中通空气(氧化剂)的一极应为正极,所以:①Y(通入负极,还原剂)必为H2,继而H2产生于电解池的阴极,可推出产生于电解池阳极的X必为Cl2;a% NaOH进入燃料电池,出来后的浓度变化可用二种方法判断:[方法一]从Na+的移动方向来定:Na+向阴极(即正极)移动,所以正极b% NaOH浓度增大,负极流出的NaOH变稀;[方法二]从水、OH-的量变来定:负极H2-2e-+2OH-=2H2O,水增多、OH-减少,变稀;正极O2+4e-+2H2O=4OH-,水减少、OH-增多,所以正极增浓,即a<b。
本题难度:困难
3、选择题 将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
A.电子由锌片经导线流向铜片
B.铜片作正极,锌片作负极
C.溶液中SO42- 的物质的量浓度保持不变
D.溶液中Cu2+移向负极
参考答案:D
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的铜离子在正极得到电子,所以选项A、B、C都是正确的,D不正确,溶液中Cu2+移向正极,答案选D。
点评:该题高考中的常见考点,属于基础性试题的考查,难度不大。重点考查学生对原电池原理,特别是电极名称和电极反应式书写的了解掌握情况,意在培养学生的逻辑推理能力。明确原电池的工作原理是答题的关键。
本题难度:一般
4、填空题 (1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上________
(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为______,正极的电极反应式为___________。
(2)如果烧杯中最初装入的是500mL 2 mol·L-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)________________________。
参考答案:(1)没有 锌片 2H++2e-=H2↑
(2)c(H2SO4)=1 mol·L-1,c(ZnSO4)=1 mol·L-1
本题解析:铜片插入稀硫酸中时,二者不反应,没有气泡产生,但当把铜片和锌片用导线相连插入稀硫酸中时,会构成原电池,铜作为原电池正极,电极反应为2H++2e-=H2↑,锌作为原电池负极,电极反应为Zn-2e-=Zn2+,电池总反应为Zn+2H+=Zn2++H2↑。当收集到11.2L H2(标准状况),即0.5 mol H2时,消耗的H2SO4为0.5mol,生成的ZnSO4为0.5mol,c(H2SO4)= =1 mol·L-1,c(ZnSO4)=
=1 mol·L-1,c(ZnSO4)=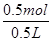 =1 mol·L-1。
=1 mol·L-1。
本题难度:简单
5、选择题 某电化学实验装置如图所示,下列说法正确的是
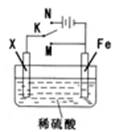
A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极
B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2
C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀
D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+
参考答案:D
本题解析:A.若X为碳棒,开关K置于M处,则装置是原电池,Fe是负极,C作正极,根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的H+移向负电荷较多的正极C棒。错误。? B.若X为碳棒,开关K置于N处,该装置为电解池,转移0.2mole一时析出0.05molO2。错误。? C.若X为铜棒,开关K置于M处,Fe、Cu及硫酸构成原电池,Fe作负极,可以加快铁的腐蚀;若开关K置于N处,Cu为阳极,发生反应失去电子,而Fe作阴极而被保护,因此可减缓铁的腐蚀。错误。D.若X为锌棒,开关K置于M处,构成的是Zn、Fe原电池,Zn的活动性比Fe强,所以锌电极上反应为Zn-2e一=Zn2+;当或开关K置于N处,该装置为电解池,Zn是阳极,是活性电极,发生反应Zn-2e一=Zn2+;正确。
本题难度:一般