微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,回答下列问题:
(1)
| 应取浓硫酸的体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器
|
(2)配制操作可分解成如下几步:
A向容量瓶中注入少量蒸馏水,检查容量瓶是否漏水
B用少量蒸馏水洗涤烧杯,将溶液注入容量瓶,并重复操作两次
C将已冷却的硫酸注入容量瓶中
D根据计算,用量筒量取一定体积的浓硫酸
E将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F盖上容量瓶塞子,振荡,摇匀,装瓶
G用胶头滴管继续加蒸馏水,使溶液凹面恰好与刻度相切
H继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
正确的操作顺序是:A______F
(3)下列操作结果,使溶液物质的量浓度偏低的是______
A没有将洗涤液转移到容量瓶中
B容量瓶洗净后未经干燥处理
C转移过程中有少量的溶液溅出
D摇匀后立即观察,发现溶液未达刻度线,没有再用滴管加几滴蒸馏水至刻度线.
参考答案:(1)配制100mL 0.92mol/L的稀硫酸,需要选用100mL容量瓶,配制的稀硫酸中含有硫酸的物质的量为:0.92mol/L×0.1L=0.092mol,需要18.4mol/L的浓硫酸的体积为:0.092mol18.4mol/L=0.005L=5.0mL;配制过程中需要使用的仪器除了100mL容量瓶外,还需要的仪器有:量筒、烧杯、玻璃棒、胶头滴管,
故答案为:5.0;100;量筒、烧杯、玻璃棒、胶头滴管;
(2)配制100mL 0.92mol/L的稀硫酸的步骤为:查漏、计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确存在顺序为:ADECBHGF,
故答案为:DECBHG;
(3)A没有将洗涤液转移到容量瓶中,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A正确;
B容量瓶洗净后未经干燥处理,对溶液体积和溶质的物质的量都没有影响,所以不影响配制结果,故B错误
C转移过程中有少量的溶液溅出,导致配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故C正确;
D摇匀后立即观察,发现溶液未达刻度线,没有再用滴管加几滴蒸馏水至刻度线,该操作正确,不会对配制结果产生影响,故D错误;
故选AC.
本题解析:
本题难度:一般
2、填空题 某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种离子。
①该溶液的焰色反应呈现出紫色。
②取10 mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。
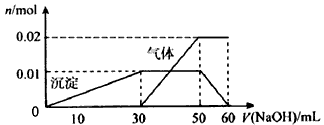
(1)该溶液中一定含有____________(填离子的化学式)离子,一定不含有的离子有___________(填离子的化学式)。
(2)①根据图中所示数据,计算实验中使用的NaOH溶液的物质的量浓度为______________
②在配制实验所需100 mL NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要__________
(填仪器名称)。
(3)根据图示信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为______________
参考答案:(1)K+、NH4+、Al3+、SO42-;Cl-、Fe3+
(2)①1 mol/L;②100 mL容量瓶、胶头滴管
(3)1 mol/L
本题解析:
本题难度:困难
3、选择题 关于1mol?L-1的Na2SO4溶液的叙述正确的是( )
A.溶液中含2molNa+
B.Na+的浓度为1mol?L-1
C.配制时,将1molNa2SO4溶于1L水中
D.将142gNa2SO4溶于少量水后再稀释成1L,即配制成相应浓度的溶液
参考答案:D
本题解析:
本题难度:简单
4、选择题 配制一定物质的量浓度溶液时,能使所配溶液的浓度偏高的原因是( )
A.没有用水冲洗烧杯2-3次
B.溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
C.定容时俯视液面使与刻度线相切
D.定容时仰视液面使与刻度线相切
参考答案:C
本题解析:
本题难度:一般
5、填空题 用2.4mol/L的H2SO4溶液配制100mL浓度为0.2mol/L的稀H2SO4,回答下列问题:
(1)需用量筒量取2.4mol/L的H2SO4溶液的体积是______mL
(2)配制过程有下列几步操作:
A.用10mL量筒量取所需体积的H2SO4溶液,注入烧杯中,用玻璃棒搅拌,使其混合均匀;
B.将蒸馏水加入容量瓶至液面接近刻度线1cm~2cm处;
C.向烧杯中加入约20mL蒸馏水;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也转移到容量瓶中;
E.用______加水至刻度线;
F.将烧杯中溶液冷却后,沿玻璃棒转移到______;
G.盖好瓶塞,反复颠倒摇匀.
完成上述步骤,且以上各步骤操作的先后顺序是______(填字母)
(3)取上述所配溶液10mL与足量BaCl2溶液反应,生成白色沉淀0.48g.则该溶液浓度______0.2mol/L(填“大于”“等于”或“小于”),造成此误差的操作可能是______
A.定容时俯视容量瓶;?B.用量筒取2.4mol/LH2SO4溶液时俯视读数;C.使用容量瓶前未干燥;D.使用的烧杯和玻璃棒未洗涤彻底;E.定容时将蒸馏水洒在容量瓶外面.
参考答案:(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×2.4mol/L=100mL×0.2mol/L,解得:x≈8.3,所以应量取的硫酸体积是8.3mL;
故答案为:8.3mL;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀,故操作顺序为CAFDBEG;
故答案为:胶头滴管,100mL容量瓶,CAFDBEG;
(3)白色沉淀是硫酸钡,硫酸钡的物质的量为0.48g233g/mol=0.48233mol,所以n(H2SO4)=n(BaSO4)=0.48233mol,故所配硫酸溶液的浓度为0.48233mol0.01L=0.21mol/L>0.2mol/L;
A.定容时俯视容量瓶,所配溶液体积偏小,配制人一样的浓度偏大,故A符合;
B.用量筒取2.4mol/LH2SO4溶液时俯视读数,量取硫酸溶液的体积偏小,所配溶液的浓度偏小,故B不符合;
C.配制需加水定容,使用容量瓶前未干燥,对所配溶液浓度无影响,故C不符合;
D.使用的烧杯和玻璃棒未洗涤彻底,移入容量瓶内溶质硫酸的物质的量偏小,所配溶液浓度偏小,故D不符合;
E.定容时将蒸馏水洒在容量瓶外面,可以继续加水,对所配溶液浓度无影响,故E不符合;
故答案为:大于,A.
本题解析:
本题难度:一般