微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
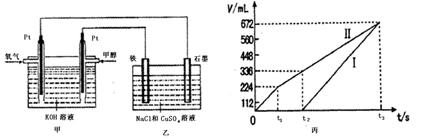
(1)写出甲中通入甲醇这一极的电极反应式?。
(2)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式?,原混合溶液中NaCl的物质的量浓度为??mol/L,CuSO4的物质的量浓度为??mol/L。(假设溶液体积不变)
(3)电解至t3时,消耗水的质量为??g。
参考答案:(1)CH3OH-6e-+8OH-=CO32-+6H2O(2分)
(2)4OH--4e-=O2↑+2H2O (2分)? 0.1(2分)? 0.1(2分)
(3)0.72 (2分)
本题解析:(1)甲图为甲醇燃料电池, 2CH3OH+3O2=2CO2+4H2O?①
CO2+2KOH=K2CO3+H2O?②
①+②×2,得:甲醇燃料电池的总化学反应为:2CH3OH+3O2+4KOH=6H2O+2K2CO3
总离子反应为:2CH3OH+3O2+4OH-=6H2O+2CO32-
(+):O2+2H2O+4e-=4OH-
(-)=总离子反应-(+)×3,得:2CH3OH+16OH--12e-=12H2O+2CO32-
化简,得:CH3OH - 6e-+ 8OH- = CO32-+ 6H2O
(2)乙图为电解池,铁片接甲图的负极,故铁片做电解池的阴极;
石墨棒接甲图的正极,故石墨棒做电解池的阳极;
溶液中阴离子(Cl-、OH-、SO42-)移向阳极,且放电顺序为:Cl->OH->SO42-,
电极反应为:先2Cl--2e-=Cl2↑,后4OH--4e-=O2↑+2H2O
阳离子(Cu2+、H+、Na+)移向阴极,且放电顺序为:Cu2+>H+>Na+,
电极反应为:先Cu2++2e-=Cu,后2H++2e-=H2↑
故丙图中,I线对应阴极(铁片)的反应,II线对应阳极(石墨棒)的反应;
分析丙图:到t1时,生成V(Cl2)=224ml,标准状况下n(Cl2)="0.01" mol,
2Cl--2e-=Cl2↑
2? 1
n(Cl-)? 0.01mol,则n(Cl-)= 0.02mol,C(NaCl)="0.02mol/0.2L=0.1" mol/L;
V(O2)="672ml-224ml=448" ml,标准状况下n(O2)="0.02" mol,故阳极失电子的物质的量为:
2Cl-- 2e- = Cl2↑? 4OH-- 4e- = O2↑+2H2O
2? 1? 4? 1
0.02mol? 0.01mol? 0.08mol 0.02mol
两极电子转移守恒(均为0.02mol+ 0.08mol=0.1mol),则阴极得电子的物质的量为:
V(H2)="672ml," 标准状况下n(H2)=0.03mol,
2H++ 2e- = H2↑?故? Cu2+ + 2e-?=Cu
2? 1? 1? 2
0.06mol 0.03mol? 0.02mol 0.04mol
C(CuSO4)="0.02mol/0.2L=0.1" mol/L;
(3)2H2O=2H2↑+O2↑
36g? 1mol
0.72g? 0.02mol
本题难度:一般
2、选择题 下列与金属腐蚀有关的说法正确的是( )
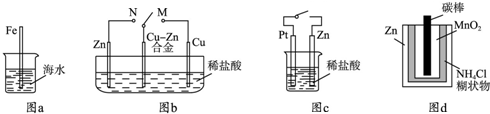
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
参考答案:A.图a中,铁棒发生化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,故A错误;
B图b中开关由M置于N,Cu-Zn作正极,腐蚀速率减小,故B正确;
C.图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;
D.图d中干电池放电时MnO2发生还原反应,体现锌的还原性,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=H2
B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH-
D.Fe3++e-=Fe2+
参考答案:C
本题解析:原电池中负极失去电子,发生氧化反应;正极得到电子,发生还原反应。所以钢铁的吸氧腐蚀中,铁是负极,氧气在正极得到电子,答案选C。
本题难度:一般
4、选择题 下列事实中,与电化学腐蚀无关的是( )
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.埋在潮湿疏松土壤里的铁管比埋在干燥致密不透气的土壤里的铁管更易被腐蚀
D.在空气中,金属银的表面生成一层黑色物质
参考答案:A.轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,故A正确;
B.镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀,发生原电池反应而可用电化学知识解释,故B正确;
C.埋在潮湿土壤里的铁管,铁、C和潮湿的空气形成原电池,加快了铁的腐蚀,而干燥土壤里的缺少电解质溶液,不能形成原电池,不易腐蚀,属于此现象与电化学知识有关,故C正确;
D.银在空气中被氧气氧化发生化学腐蚀,与电化学腐蚀无关,故D错误.
故选D.
本题解析:
本题难度:一般
5、选择题 分别放置下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是(?)
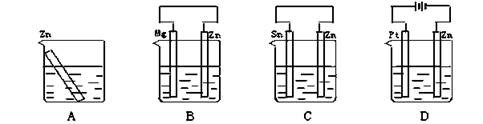
参考答案:C
本题解析:A中发生化学腐蚀,B中镁作负极,锌作正极,锌不易被腐蚀,C中锌作负极,发生电化学腐蚀,加快锌的腐蚀,D中锌作电解池阴极,不易被腐蚀,所以腐蚀最快的是C。
本题难度:一般