微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式表示错误的是
A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3- + Ba2+ + OH-==BaCO3↓ + H2O
B.Fe2O3溶于过量氢碘酸溶液中: Fe2O3 + 6H+ + 2I-="=" 2Fe2+ + I2 +3H2O
C.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体: Fe3+ + 3H2O = Fe(OH)3↓ + 3H+
D.铜片加入稀硝酸中:3Cu +2NO3- + 8H+="=" 3Cu2+ + 2NO↑ + 4H2O
参考答案:C
本题解析:C错,该反应过程为实验室制氢氧化铁胶体过程,生成的胶体不能用沉淀符号表示;
本题难度:一般
2、填空题 用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是______
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是______
(3)D是由两种元素组成的三原子分子,电子式是______
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式______
(5)E+F→C+D写出该方程式______.
参考答案:含有10个电子的微粒有:CH4、NH3、H2O、HF、NH4+、OH-、H3O+、O2-、F-、Na+、Mg2+、Al3+等,则
(1)A离子为单核离子且A原子在所在周期中原子半径最大,则A为Na元素,A离子是Na+,故答案为:Na+;
(2)由两种元素组成的分子,其水溶液呈碱性的物质是NH3,故答案为:NH3;
(3)由两种元素组成的三原子分子为H2O,其电子式为
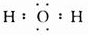
,故答案为:
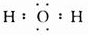
;
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,则B为Al3+,F为OH-,反应的离子方程式分别有:
Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+H2O;
(5)由以上分析可知E为NH4+,F为OH-,C为NH3,D为H2O,反应的离子方程式为NH4++OH-=NH3+H2O,
故答案为:NH4++OH-=NH3+H2O.
本题解析:
本题难度:一般
3、选择题 下列离子方程式不正确的是( )
A.钠与水的反应2Na+2H2O=2Na++2OH-+H2↑
B.碳酸氢钙与盐酸的反应HCO3-+H+=H2O+CO2↑
C.氯化亚铁溶液中通入氯气Fe2++Cl2=Fe3++2Cl-
D.硫酸与氢氧化钠溶液的反应H++OH-=H2O
参考答案:A、钠与水的反应,生成了氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A正确;
B、碳酸氢根离子与盐酸反应生成了可溶性的氯化钙、二氧化碳和水,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故B正确;
C、氯化亚铁溶液中通入氯气,亚铁离子被氯气氧化成铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故C错误;
D、硫酸与氢氧化钠溶液的反应的离子方程式为:H++OH-=H2O,故D正确;
故选C.
本题解析:
本题难度:简单
4、选择题 下列反应的离子方程式正确的是
[? ]
A.钠与水反应:2Na+2H2O=2Na++OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+ == Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+==H2O+CO2↑
D.NaOH溶液与小苏打溶液反应:HCO3-+OH-==CO32-+H2O
参考答案:D
本题解析:
本题难度:一般
5、简答题 有X、Y、Z、W四种在中学学过的固体化合物,实验现象如下:
①X、Y、Z、W的焰色反应均为黄色.
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出.
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解.
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现.其中W溶液中气泡出现较快.
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成.
根据上述现象,回答下列问题:
(1)X的化学式为______,Y的化学式为______;
(2)写出下列有关反应的化学方程式或离子方程式.
①Z+石灰水(离子方程式)______;
②X+CO2(化学方程式)______;
③W
(化学方程式)______.
参考答案:由①X、Y、Z、W的焰色反应均为黄色,证明含钠元素;
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出,可推断为碳酸钠或碳酸氢钠;
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解,证明ZW为碳酸钠和碳酸氢钠,Y可能为硫酸钠或硫酸氢钠;
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现.其中W溶液中气泡出现较快,说明Y一定为NaHSO4;
⑤X与CO2反应生成Z,推断Z为Na2CO3,W为NaHCO3,同时生成另一种气体,此气体由地壳中含量最多的元素组成,判断为O2;所以X为Na2O2;
综上所述:X为Na2O2、Y为NaHSO4、Z为Na2CO3、W为NaHCO3;
(1)依据分析判断X的化学式为Na2O2,Y的化学式为NaHSO4,故答案为:Na2O2;NaHSO4;
(2)①Z(Na2CO3)+石灰水反应的离子方程式:Ca2++CO32-═CaCO3↓,故答案为:Ca2++CO32-═CaCO3↓;?
②X(Na2O2)+CO2化反应的学方程式:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
③W△
本题解析:
本题难度:一般