微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应aA(g)+bB(s)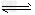 cC(g)+dD(g).在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是
cC(g)+dD(g).在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是

[? ]
A.温度降低,化学平衡向逆反应方向移动?
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.无法根据图像确定改变温度后化学平衡移动方向
参考答案:C
本题解析:
本题难度:一般
2、填空题 800℃时,在2L密闭容器内充入0.50molNO和0.25molO2,发生如下反应:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表
2NO2(g) △H<0。体系中,n(NO)随时间的变化如表

(1)能说明该反应已达到平衡状态的是_______________。
A、v(NO2)正=v(O2)逆
B、容器内压强保持不变
C、v(NO)逆=2v(O2)正
D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_________________。
A、适当升高温度
B、缩小反应容器的体积
C、增大O2的浓度
D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K=____________。
参考答案:(1)BCD
(2)BC
(3)K=16
本题解析:
本题难度:一般
3、选择题 将?1mol SO2和?1mol?O2?通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时?SO3为0.3mol,若此时移走?0.5mol?O2和?0.5mol?SO2则反应达到新的平衡时,SO3的物质的量是( )
A.0.3mol
B.0.15mol
C.小于?0.15mol
D.大于0.15mol而小于?0.3mol
参考答案:将lmolSO2和lmolO2通入体积不变的密闭容器中,反应达到平衡时移走?0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2,所到达的平衡状态,与原平衡相比,压强降低,平衡向逆反应移动,反应的转化率降低,若转化率不变时,生成的SO3为0.15mol,由于转化率降低,故生成的SO3小于0.15mol,故选C.
本题解析:
本题难度:一般
4、填空题 氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
(1)一定条件下,向一个2L的密闭容器中充入2mol N2和6 molH2,反应达平衡时放出93 kJ热量,生成NH3
的浓度为1mol/L,试写出该反应的热化学方程式:______________________
(2)现有一支10 mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体2 mL。则通入氧气的体积可能为__________________
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)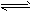 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
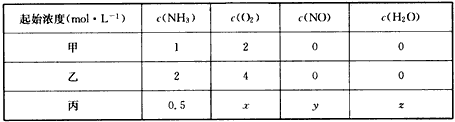
①恒温恒容下,平衡时NH3的转化率甲____(填“>”“=”或“<”)乙。
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=____,y=____,z=____。
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:
2NO2(g)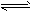 N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和
N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和
a2。已知T1<T2,则a1____a2。
A.大于 B.小于 C.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是____。
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3·H2O)
D.c(NH4+)+c(NH3·H2O)=1.5c(NO3-)
参考答案:(1)N2(g)+3H2(g)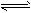 2NH3(g) △H=-93 kJ/mol
2NH3(g) △H=-93 kJ/mol
(2)6 mL和9.5mL
(3)①>;②1.375;0.5;0.75
(4)D
(5)AC
本题解析:
本题难度:困难
5、填空题 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
(1)CO可用于合成甲醇.在体积可变的密闭容器中充入4mol CO和8mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(Ⅰ)平衡时CO的转化率与温度、压强的关系如图所示:
①该反应的逆反应属于______反应;(填“吸热”或“放热”).
②在0.1Mpa、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的______倍.(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4mol CO,8mol H2,达到平衡时CO转化率______(填“增大”,“不变”或“减小”),平衡常数K______(填“增大”,“不变”或“减小”).
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法.已知:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ?mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:______.
(3)在反应(Ⅰ)中制得的CH3OH即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液.则该燃料电池放电时:负极的电极反应式为______.
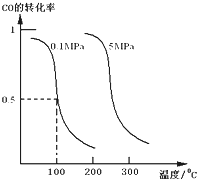
参考答案:(1)①图象分析,一氧化碳的转化率随温度升高减小,正反应为放热反应,逆反应为吸热反应;
故答案为:吸热;
②0.1Mpa、100℃的条件下,一氧化碳的转化率为0.5,消耗一氧化碳物质的量为4mol×0.5=2mol,依据平衡三段式得到;
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 4 8 0
变化量(mol) 2 4 2
平衡量(mol) 2 4 2
则反应达到平衡时容器体积和开始容器体积之比:V(平):V(起)=n(平):n(起)=8:12=0.67
反应达到平衡时容器体积为开始容器体积的0.67倍;
故答案为:0.67;
③在温度和容积不变的情况下,再向平衡体系中充入4mol CO,8mol H2,为保持恒压体积增大,最后达到平衡状态和原来平衡状态相同,达到平衡时CO转化率不变;平衡常数随温度变化,温度不变,平衡常数不变;
故答案为:不变,不变;
(4)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ?mol-1
依据盖斯定律计算,①×2-②则CH4和H2O(g)反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ?mol-1;
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ?mol-1;
(5)CH3OH即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液.则该燃料电池放电时是原电池,负极上是甲醇失电子发生氧化还原反应生成碳酸盐,反应的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
本题解析:
本题难度:一般