微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是______
(2)X与W组成的化合物中存在______键(填“离子”“共价”).
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为______.
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol?A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式______.
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
______.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol?B中含有6mol结晶水.对化合物B进行如下实验:
a?取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b?另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为______.
②已知1mol?L-1?100mL?B的溶液能与1mol?L-1?20mLKMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式______.
参考答案:(1)在周期表中X是原子半径最小的元素,故X是H,故答案为:H;
(2)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族,X元素是H,故Y、Z、W原子序数之和为31,设Z的原子序数为a,则Y的原子序数为a-1,W的原子序数为a+8,故a-1+a+a+8=31,a=8,故Z为O,Y为N,W为S,X与W组成的化合物为硫化氢,其中存在共价键,
故答案为:共价;
(3)由氢、氮、氧、硫中的三种组成的能与铜反应的强酸为硝酸,反应的离子方程式为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O;
(4)①由氢、氮、氧、硫组成的离子化合物可能为硫酸铵、硫酸氢铵、亚硫酸铵、亚硫酸氢铵等,1 mol生成气体2 mol说明一分子这种离子化合物中含有2分子铵根离子,铵根离子与氢氧根离子反应方程式为NH4++OH-?△?.?H2O+NH3↑,故答案为:NH4++OH-?△?.?H2O+NH3↑;
②此种化合物与氯气反应说明为亚硫酸根离子,故此种化合物为亚硫酸铵,与氯气反应的离子方程式为②SO32-+Cl2+H2O=SO42-+2Cl-+2H+,故答案为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+;
(5)①B中含有氢、氮、氧、硫、铁五种元素,取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,说明B中有亚铁离子和铵根离子,B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,说明有硫酸根离子,1mol?B中含有6mol结晶水,说明B带六个结晶水,由相对分子质量为392可知道分子式只能为(NH4)2Fe?(SO4)2?6H2O,故答案为:(NH4)2Fe?(SO4)2?6H2O;?
②B的物质的量为0.1 mol,高锰酸根离子的物质的量为0.02 mol,说明亚铁离子与高锰酸根离子以5:1的比例恰好完全反应,故离子方程式为②5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
本题解析:
本题难度:一般
2、选择题 在图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大。则气体X与液体Y
不可能是
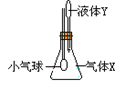
?
| A
| B
| C
| D
|
气体X
| NH3
| SO2
| CO2
| HCl
|
液体Y
| 水
| 浓NaOH
| 稀H2SO4
| 水
参考答案:C
本题解析:只要锥形瓶中气体压强减小,小气球就会胀大,
A 氨气极易溶于水,锥形瓶中气体压强减小,气球胀大
B 二氧化硫与浓NaOH反应,气体压强减小,气球胀大
C 二氧化碳与稀硫酸不反应,气体压强不变,气球不可能胀大
D HCl极易溶于水,使锥形瓶中气体压强减小,小气球胀大
本题难度:简单
3、填空题 W、X、Y、Z是原子序数依次增大的同一短同期的元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:
(1)W、X对应的最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为_____________。
(2)X的硝酸盐的水溶液显____性,用离子方程式解释原因________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________。
(4)W、X、Y、Z四种元素的简单离子的半径由大到小的顺序是:____>____>____>_____。(填离子符号)
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量的水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式_________________ 。
参考答案:(1) Al(OH)3 +OH- == AlO2- +2H2O
(2)酸;Al3++3H2O 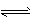 Al(OH)3 +3H+ Al(OH)3 +3H+
(3)SO2+Cl2+2H2O==H2SO4+2HCl
(4)S2->Cl->Na+>Al3+
(5) Cl2O7(1)+H2O(I)==2HClO4 (aq);△H=-4Q kJ/mol
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.元素周期表和元素周期律没有任何联系
B.元素周期表中行和列一样多
C.元素周期表中,某一列内所含元素的个数可能跟某一行中所含元素的个数相等
D.周期表中,行数(从上到下)与该行中原子的最外层电子数相等
参考答案:C
本题解析:(排除法):元素周期表是根据元素周期律编排的,元素周期律是元素周期表的表现形式,二者关系十分密切,A被排除.元素周期表号称七横十八纵,7≠18,B被排除.C项所列内容目前不太熟悉,可以暂时放一放(其实,第ⅢB族与第6行都是含有32种元素,该选项正确).元素周期表中,行数等于电子层数,不等于最外层电子数,D被排除.排除了A、B、D,可知C为答案.
本题难度:一般
5、选择题 下列叙述正确的是
A.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱
B.碳族元素的单质都有导电性
C.硅酸的酸性比碳酸的强
D.同一周期中氧族元素比碳族元素的非金属性强
参考答案:D
本题解析:
本题难度:一般
|