微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
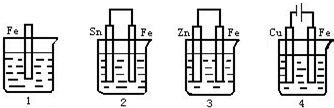
A.4>2>1>3
B.2>1>3>4
C.4>2>3>1
D.3>2>4>1
参考答案:根据图知,(2 )、(3)装置是原电池,( 4)装置是电解池;
(2 )装置中铁作负极,很容易失电子变成离子进入溶液,促进铁腐蚀的速度;
( 3)装置铁作正极,锌易失电子而使铁受到保护,抑制铁腐蚀的速度;
(4)装置中铁作阳极,在外加电源的作用下,腐蚀速度最快;
( 3)装置铁受到保护,(1)装置铁的反应速度未受到保护也未受到抑制,所以( 1)中铁的腐蚀比(3)中的快.
故答案为:(4)>(2)>(1)>(3)
本题解析:
本题难度:一般
2、填空题 如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
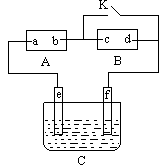
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为___________________;
(3)欲在电槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为________________,电极f上发生的反应为_____________________,
(4) 槽中放的镀液可以是________或________(只要求填两种电解质溶液)。
参考答案:1)正?(2)2NaCl+2H2O H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
(3)Zn—2e-===Zn2+? Zn2++2e-="==Zn" (4) ZnSO4溶液或ZnCl2溶液
本题解析:B上的c点显红色,说明有碱性物质生成,所以c为阴极,d为阳极,所以b为负极,a为正极,(2)滤纸B上发生的总化学方程式为2NaCl+2H2O H2↑+Cl2↑+2NaOH;(3)电极e上发生的反应为Zn—2e-===Zn2+,电极f上发生的反应为Zn2++2e-===Zn? ZnSO4;(4)槽中放的镀液为锌离子的盐溶液,即可以是ZnSO4溶液或ZnCl2溶液。
H2↑+Cl2↑+2NaOH;(3)电极e上发生的反应为Zn—2e-===Zn2+,电极f上发生的反应为Zn2++2e-===Zn? ZnSO4;(4)槽中放的镀液为锌离子的盐溶液,即可以是ZnSO4溶液或ZnCl2溶液。
点评:本题考查了原电池、电解池的综合知识,该命题方式是高考命题的热点,本题有一定的综合性,有一定的难度。
本题难度:一般
3、选择题 下列说法正确的是( )
A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用
B.SiO2不溶于强酸和强碱,可用于制光导纤维
C.Cl2与SO2使品红溶液褪色的原理相同
D.常温下浓硫酸与铝不反应,可用铝槽车运输
参考答案:A、Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故A正确;
B、SiO2溶于强碱,SiO2晶体具有导光性,可用于制光导纤维,故B错误;
C、Cl2与水反应生成HClO的具有强氧化性,能使品红褪色,SO2没有强氧化性,使品红褪色发生的是非氧化性漂白,故C错误;
D、常温下浓硫酸与铝发生钝化,在铝的表面形成致密的氧化膜,阻止反应进一步发生,所以可用铝槽车运输,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
C.钢铁在潮湿的空气中会形成原电池而被腐蚀,其正极反应为:O2 + 2H2O + 4e-=4OH-
D.原子结合成分子的过程一定释放出能量
参考答案:A
本题解析:A 错误,铅蓄电池在放电过程中,负极铅会失去电子,得到的铅离子和硫酸根离子结合生成硫酸铅沉淀,负极质量增加。
B 正确,C(s)+CO2(g)=2CO(g)是吸热反应。
C 正确,钢铁在潮湿的空气中会发生吸氧腐蚀。
D 正确,原子结合成分子的过程是形成化学键的过程,一定释放出能量。
本题难度:简单
5、选择题 利用如图装置可以模拟铁的电化学防护。下列叙述正确的是? ( )。
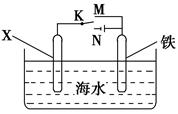
A.铁被腐蚀过程实质是金属铁发生了还原反应
B.若X为锌片,开关K置于M处,可减缓铁的腐蚀
C.若X为碳棒,开关K置于M处,可减缓铁的腐蚀
D.当K置于N处时,可减缓铁的腐蚀
参考答案:B
本题解析:铁被腐蚀是铁发生了氧化反应,A错误;当X为锌,K置于M处时,构成原电池,铁作正极被保护,B正确;当X为碳棒,K置于M处时,仍构成原电池,铁作负极,加快了金属的腐蚀,C错误;当K置于N处时,构成电解池,铁作阳极,加快了金属的腐蚀,D错误。
本题难度:一般